
2.[江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ](8分))铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
⑴上表所列铜化合物中,铜的质量百分含量最低的是 。
⑵工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化产物是 ;每生成1molCu转移电子的数目是 。
6Cu+SO2↑,反应的氧化产物是 ;每生成1molCu转移电子的数目是 。
⑶黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解精炼时阳极的电极方程式 。
答案 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
⑴略
⑵SO2 NA
⑶
Cu-2e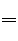 Cu2+
Cu2+
1.[江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ](10分)已知有以下物质相互转化
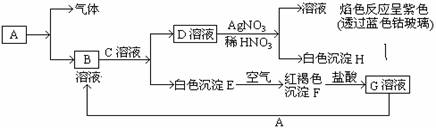
试回答:⑴写出B的化学式 ,D的化学式 。
⑵写出由E转变成F的化学方程式 。
⑶写出用KSCN鉴别G溶液的离子方程式_________ ;向G溶液加入A的有关离子反应方程式 _____________
答案 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
⑴FeCl2 KCl ⑵4Fe(OH)2+2H2O+O2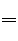 4Fe(OH)3
4Fe(OH)3
⑶Fe3++3SCN-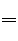 Fe(SCN)3 2Fe3++Fe
Fe(SCN)3 2Fe3++Fe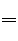 3Fe2+
3Fe2+
20.(江苏海州高级中学2009届高三化学第三次综合测试) (8分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: g(用x表示);
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ;
(3)若x =0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数 。
答案..(1)1500+375X (2) 10:33 (3) 52.7%
(1)375x + 1500 (2)10∶3.3
(3)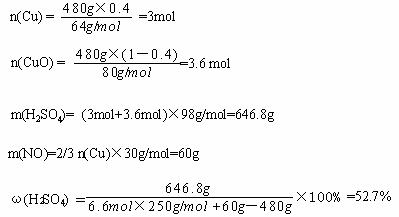
19.[江苏省口岸中学2009届高三年级第二次月考化学试题] (10分)金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
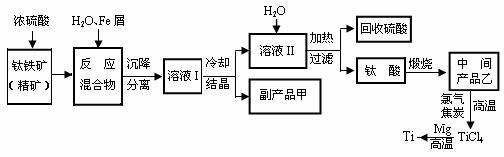 回答下列问题:
回答下列问题:
⑴ 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
⑵ 上述生产流程中加入Fe屑的目的是 ,检验副产品甲是否变质的实验方法是 。
⑶ 上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
⑷ 最近,用熔融法直接电解中间产品乙制取金属钛获得成功。写出电解乙制取金属钛的化学方程式 。
答案.⑴ FeSO4·7H2O ⑵ 防止Fe2+氧化
取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色 ⑶ 稀盐酸 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
 ⑷ TiO2 Ti+O2↑
⑷ TiO2 Ti+O2↑
18.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
17.[江苏省姜堰市姜淮培训中心2009届高三化学周练九]某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是[ AD ]
A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B、若金属全部溶解,则溶液中一定含有Fe3+
C、若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
w.w.w.k.s.5.u. c.o.m
16.[江苏省姜堰市姜淮培训中心2009届高三化学周练九]由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)
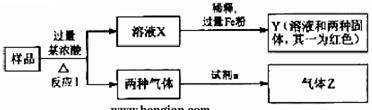
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是____________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是______。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是__________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)__________。
答案.. (1)Al
(2)① C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
② NO CO2
(3)Cu2+ Fe3+ H+
(4)2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2
(5)CuO、C; CuO、C、Fe2O3
15、[江苏省姜堰市姜淮培训中心2009届高三化学周练九].根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
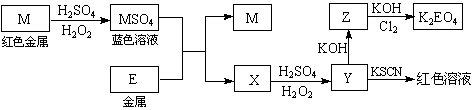
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
 ⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: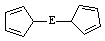 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
答案.. ⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I- == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
14.[ 连云港新海高级中学09届高三化学九月质量检查试题]在500mLCuSO4和Fe2(SO4)3的混和溶液中加入21.7g 铁粉,待反应完全后,得到16.8g残留固体。在滤液中加入400mL4mol / L的BaCl2溶液,恰好使溶液中的SO42-完全沉淀。求原混合物中CuSO4和Fe2(SO4)3的物质的量浓度。
答案.硫酸铜的物质的量浓度为2.45mol/L 硫酸铁的物质的量浓度为0.25mol/L
13.[江苏省赣榆高级中学2009年高考双周模拟试卷 ](11分)
⑴ 下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙,常用于物质分离的是 (填编号)。
⑵ 某同学为验证苯的沸点(80.1℃)比水低,以试管取用少量的苯放在水浴中,并在水浴中插一温度计。实验开始后,用酒精灯给水浴加热。
该实验有一个明显的缺点。指出这个缺点,并说明如何改进。
。
⑶ 为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同学们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:
_ _
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。
当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜极所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出):____________________________________________________ __ 。
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表
现为:__________________________________________________ 。
答案.(1)①③⑤(2分,漏选得1分,多选0分)
(2)苯挥发造成空气污染(1分),应在试管上加一单孔塞,孔中插一长直导管(1分)
(3)Fe3+>Cu2+>H+>Fe2+ (2分)
2Fe3++2e-=2Fe2+; Cu2++2e-=Cu ; 2H++2e-=H2↑; (3分)
①有污染性气体Cl2 产生 ② 使用了电解装置,成本较高;等。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com