
9.[江苏省姜堰市姜淮培训中心2009届高三化学周练九]某同学用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是[ C ]
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol-0.6 mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol-0.6 mol之间
8.[ 连云港新海高级中学09届高三化学九月质量检查试题]从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
② 将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
7.[江苏省赣榆高级中学2009年高考双周模拟试卷 ](10分)
金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
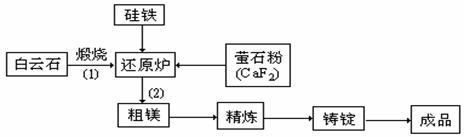
⑴ 在冶炼过程中反应温度对生成金属镁的影响如图。
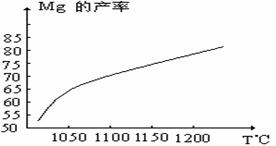
从图中分析,还原反应的反应热△H 0(填“<”“>”“=”)。理由是 。
⑵ 还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
⑶ 含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2• 6H2O),其中
KCl•MgCl2•
6H2O属于
(填序号)。
A.纯净物 B.混合物 C.配合物
⑷ 写出下列反应的方程式
①煅烧白云石 ;
②CaO•MgO与Si的反应 。
答案⑴△H>0(1分),升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应(2分)
⑵①降低反应所需温度,节约能源(1分)
②防止Mg被空气氧化(1分)
⑶A(1分)
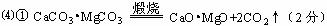
说明:产物为SiO2+2MgO得0分。
说明:产物为SiO2+2CaO得1分,为CaO+CaSiO3得2分。
6.[江苏省启东中学2009届高三阶段调研测 ]由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是[ D ]
A ②④⑤③① B ③②④①⑤ C ③④②⑤① D ②④③⑤①
5.[江苏省启东中学2009届高三阶段调研测 ]将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。.则下列说法不正确的是[ D ]
 A.镁和铝的总质量为9 g
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
4.[江苏省启东中学2009届高三阶段调研测 ]设NA表示阿伏加德罗常数,下列说法中不正确的是[ B ]
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
3.[江苏省南通市2009届高三期中检测11月] (6分)将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L一1的盐酸,可恰好使反应过程中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?
解:有关反应为:2Na2O2+2H2O=4NaOH+02↑
2Al+2NaOH+2H2O=2NaAl02+3H2↑
NaAlO2+HCl+H20=Al(OH)3↓+NaCl
A1(OH)3+3HCl3+3HCl=AlCl3+3H20
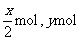 最终溶液中所含溶质为NaCl、AlCl3,
最终溶液中所含溶质为NaCl、AlCl3,
设NaCl、AlCl3的物质的量分别为x mol,ymol,则Na202、Al的物质的量分别为 ,依题意有:
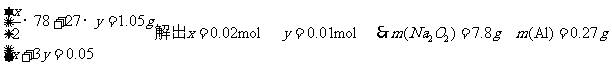
2.[江苏省南通中学2008学年度第一学期期末复习高三化学 ]向含 l mol HCl和l mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是

1.[江苏省南通中学2008学年度第一学期期末复习高三化学 ]金属镁溶于一定浓度的硝酸的反应中,产生标准状下的N2O气体5.6L,在所得的溶液中加入适量的氢氧化钠溶液,完全反应后过滤出沉淀,经洗涤并充分灼烧,最后得到固体物质的质量为
A.58g B.29g C.40g D.20g
3.[江苏徐州六县一区2009届高三第一学期联考试卷](9分)一种新型高效净水剂PAFC--聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
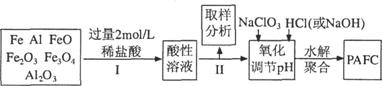

请回答下列问题:
(1)下列关于PAFC的说法中正确的是( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(2)步骤I中加入过量稀盐酸的目的一方面是使固体完全溶解,另一方面是 ▲ 。
(3)步骤II中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
|
D.测定溶液中A13+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为 ▲ 。
该化工厂的化验室为测定产品PAFC中Al和Fe两种元素的含量,进行下列试剂的选择和基本操作: w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
(5).测定时所需的试剂有 ▲ 。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6).测定时,直接测定的是 ▲ 和 ▲ 的质量(填化学式)。
(7).在测定过程中的操作顺序是 ▲ (按操作顺序选择填写)。
A.萃取 B.分液 C.过滤 D.蒸发 E.洗涤 F.称量 G.灼烧 H.冷却
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com