
4.[ 连云港新海高级中学09届高三化学九月质量检查试题](10分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分布为:
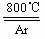 TiO2 +2C+2Cl2
TiO2 +2C+2Cl2 TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
w.w.w.k.s.5.u. c.o.m
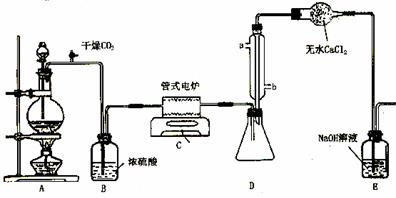
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中的反应的离子方程式为__________________________________ 。
⑶ 操作①的目的是_________________________________ 。
⑷ 装置D中冷凝管进水口的位置是(填a或b)__________ ,
装置E的作用是___________________________________________________ 。
⑸ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑹ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
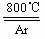 TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
答案.⑴ ③①④② (2分)
② MnO2+4H+
+2 Cl- Mn2+ + Cl2↑+2H2O
(2分)
Mn2+ + Cl2↑+2H2O
(2分)
⑵ 排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解 (1分)
⑶ b (1分),⑷吸收多余的Cl2,以免污染空气(1分)
⑸TiCl4 + 4H2O == 4HCl + Ti(OH)4(2分) ⑹防止Mg和Ti被空气中氧气氧化 (2分)
l 6[ 连云港新海高级中学09届高三化学九月质量检查试题](10分)硫酸工厂周围的空气中有较多的二氧化硫。某研究学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
l 方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.请回答:
l
l (1)加入过量的氯化钡溶液的目的是 。
l (2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,
l 说明 。
l (3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)。
__________________________________________________________________________________________________________________________________________________________________________ w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
l
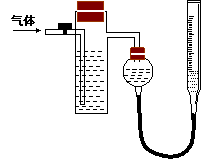 方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”“偏低”或“不受影响:)。
(5)反应管内的碘的淀粉溶液可以用下列的 (填代号)代替:
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)若碘溶液体积为VamL ,浓度为c mol·L-1。剩余气体的体积为VbmL(已折算成标准状态下的体积)。用c、Va、Vb表示SO2的体积分数为:
(7)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为是 。
答案..(10分)(1)(1分)使生成的SO42-完全转化为沉淀
(2)(2分)所加入的BaCl2溶液过量,SO42-完全转化为沉淀
(3)(2分)取最后滤出的洗液少量于一试管中,滴入AgNO3溶液。若溶液变浑浊,则可溶性物质还未除尽;若溶液仍澄清,则可溶性物质已除尽。(操作、试剂各1分,现象和结论1分)
(4)(1分)偏低,(5)(1分)B (多选或错选都不得分)
3.[ 连云港新海高级中学09届高三化学九月质量检查试题]从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
② 将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
2.[江苏省赣榆高级中学2009年高考双周模拟试卷 ](10分)
金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
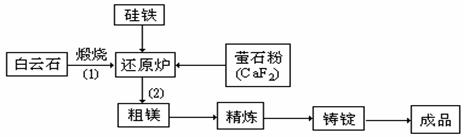
⑴ 在冶炼过程中反应温度对生成金属镁的影响如图。
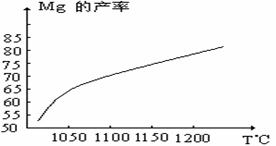
从图中分析,还原反应的反应热△H 0(填“<”“>”“=”)。理由是 。
⑵ 还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
⑶ 含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2• 6H2O),其中
KCl•MgCl2• 6H2O属于 (填序号)。
A.纯净物 B.混合物 C.配合物
⑷ 写出下列反应的方程式
①煅烧白云石 ;
②CaO•MgO与Si的反应 。
答案.⑴△H>0(1分),升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应(2分)
⑵①降低反应所需温度,节约能源(1分)
②防止Mg被空气氧化(1分)
⑶A(1分)
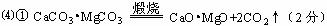
说明:产物为SiO2+2MgO得0分。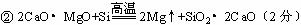
说明:产物为SiO2+2CaO得1分,为CaO+CaSiO3得2分。
1.[江苏省启东中学2009届高三第一学期第二次月考 ](10分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1) 实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
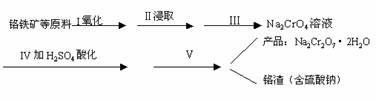
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2
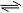 8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
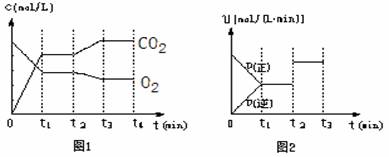
 该反应的化学平衡常数的表达式为
。
该反应的化学平衡常数的表达式为
。
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2 min时,曲线发生变化的原因是
(用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 ____ (填编号) w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
a.升高温度 b.加了催化剂 c.将原料粉碎 d.缩小容器体积
(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
②步骤Ⅳ中发生反应的离子方程式为: 。
答案..(1)①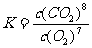 (2分)②t2
时对平衡体系降温 (2分)
b(2分)
(2分)②t2
时对平衡体系降温 (2分)
b(2分)
(2)NaA1O2[或NaA1(OH)4]、Na2SiO3(各1分,共2分,如写A1O2-、SiO32-给1分)
①除去A1O2-、SiO32-等杂质(1分) ②2CrO42-+2H+=Cr2O72-+H2O(1分)
12.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是[A]
A.3摩/升HCl B.4摩/升HNO3 C.8摩/升NaOH D.18摩升H2SO4
11.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是[C]
A.熔融的MgO不导电 B.MgO分子间作用力很大
C.MgO熔点高 D.MgO属原子晶体
10.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]某溶液中含三种离子,加入过量氨水有沉淀生成,过滤后滤液中加过量盐酸,又有沉淀生成,再过滤,滤液中加入过量Na2CO3溶液,仍有沉淀生成,原溶液中含有的离子可能是[AD] A.Ag+、Fe2+、Ca2+ B.Al3+、Mg2+、Ba2+ C.Ca2+、Fe2+、Ba2+ D.Ag+、Mg2+、Ba2+
9.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是[A]
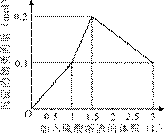
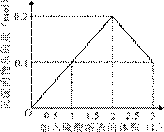
A B
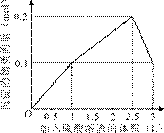
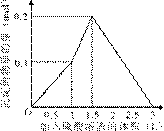
C D
8.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原和物中K+的物质的浓度为[B] w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
A.0.2mol/L B.0.25mol/L C.0.45mol/L D.0.225mol/L
7.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为amol·L-1的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L。将溶液蒸干灼烧得固体w2g。下列关系式中不正确的是[A]
A.35.5aV2=w2-w1 B.23n(Na)+27n(Al)=w1
C.n(Na)+3n(Al)=2V1/22.4 D.58.5n(Na)+51n(Al)=w2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com