
2. [江苏省赣榆高级中学2009年高考双周模拟试卷 ](10分)
[江苏省赣榆高级中学2009年高考双周模拟试卷 ](10分)
(I) 某共价化合物含 C 、 H 、 N三 元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单键和 C=C 双键。
(1) 试确定该化合物的分子式_______________________
(2) 假若某大分子 , 分子内只含 C 、 H 、 P 三种元素 , 其最小的重复的结构单元如右图,当该化合物分子中含n个磷原子时,则该化合物的组成可表示为___________________________。
(II)甘油松香酯是应用最广泛的一种松香酯,俗称酯胶,是由甘油与松香反应而得的。松香的结构简式如图1所示:
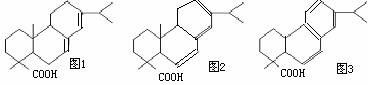
试回答下列问题:
(1)试写出松香的化学式:
(2)若1mol松香分子与1mol Br2反应,再在NaOH的醇溶液中发生反应后,再酸化
可得如图2所示的物质。试写出上述过程中松香分子与Br2反应生成的产物的结构简式:
;
(3)若已知苯环侧链上的第一个碳原子上有氢原子的话,不论侧链有多长,都会被酸性高锰酸钾氧化成羧基,则如图3所示的物质在酸性高锰酸钾溶液中充分反应后的产物中含有苯环结构的物质的结构简式为: 。
1.[江苏省启东中学2009届高三第一学期第二次月考 ] “人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
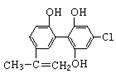
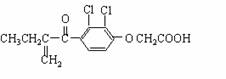
①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是 [ B ]
 A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂均属于芳香烃化合物
D.两种分子中的所有碳原子均不可能共平面
13.{江苏省赣榆高级中学09高三年级十二月 }(8分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g)  H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2
(g)+ 3H2(g)  2NH3(g) △H<0 的K=0.5,
2NH3(g) △H<0 的K=0.5,
①2NH3(g) N2 (g)+ 3H2(g)的K=
(填数值)。
N2 (g)+ 3H2(g)的K=
(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2
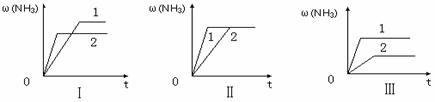
答案..(1)否(不能) (2)2, = (3)D
12.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
[问题1]工业生产碘酸钾的流程如下:

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式:_________________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是____________。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
[问题2]已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
I2+2S2O32―=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL
0.1mol/L KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
答案.[问题1](1)6I2 + 11KClO3 + 3H2O = 6KH(IO3)2 + 5KCl + 3Cl2↑;(2)蒸发结晶;
[问题2](1)分液漏斗(多写烧杯、玻璃棒等合理答案不扣分);(2)1270/3w(423.33/w)。
(3)①4I-+4H++O2=2I2+2H2O;②学生乙的实验结果会偏大。
11.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法海水淡化最理想的能源是 ;
(2)从海水中可得到多种化工原料和产品。下列是利用海水资源的流程图。

① 反应II的离子方程式为 ;
从反应III后的溶液中得到纯净的单质溴的实验操作方法是 。
② 在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ;
③ 电解25%的饱和食盐水200kg,当NaCl浓度下降到20%时,计算收集到氯气的物质的量。(溶于溶液的氯气忽略不计,计算结果保留一位小数)
答案.(12分)(⑴⑵两题每空2分) ⑴太阳能等;
⑵ ① SO2+Br2+2H2O=4H++2Br-+SO42-; 蒸馏(多写萃取不扣分);
② 苦卤样品的体积、Mg(OH)2沉淀的质量;
③ 97.7 mol。 (此小题4分,根据计算过程,酌情给分。)
说明:本试卷中其他合理答案同样给分
10.(江苏海州高级中学2009届高三化学第三次综合测试)(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号);
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
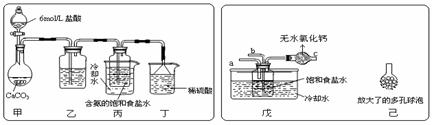 ① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是
;
(Ⅰ)乙装置中的试剂是
;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入 气体,再从b管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
答案..(1)c (2)①(Ⅰ)饱和碳酸氢钠溶液;(Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分);(Ⅲ)过滤 ②(Ⅰ)NH3,CO2 ;(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率;
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等.
9.(江苏海州高级中学2009届高三化学第三次综合测试) (12分)下图是工业生产硝酸铵的流程。

(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= 一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)
 2NH3(g) △H= 一92 kJ/mol。
2NH3(g) △H= 一92 kJ/mol。
为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3∶1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
答案. (1)使NO充分氧化为NO2;ABC。(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g),ΔH=-905.8KJ/mol K=c4(NO) c6(H2O)/c4(NO2) c5(O2)(3)CDE。(4)30%
8.[江苏省口岸中学2009届高三年级第二次月考化学试题] (10分)金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下: w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
 回答下列问题:
回答下列问题:
⑴ 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
⑵ 上述生产流程中加入Fe屑的目的是 ,检验副产品甲是否变质的实验方法是 。
⑶ 上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
⑷ 最近,用熔融法直接电解中间产品乙制取金属钛获得成功。写出电解乙制取金属钛的化学方程式 。
答案.⑴ FeSO4·7H2O ⑵ 防止Fe2+氧化 取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色 ⑶ 稀盐酸 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
 ⑷ TiO2
Ti+O2↑
⑷ TiO2
Ti+O2↑
7.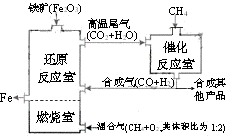 [江苏省姜堰市姜淮培训中心2009届高三化学周练九]竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)
[江苏省姜堰市姜淮培训中心2009届高三化学周练九]竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g)
∆H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g)
∆H1=+216kJ/mol;CH4(g)+ CO2(g) 2CO(g) +
2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是[AD ]
2CO(g) +
2H2(g) ∆H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是[AD ]
A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550-750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol,n(CO)=bmol,n(H2)=cmol,则通入催化反应室的CH4的物质的量为a+(b+c)/4
22.(6)(2分)4cVa / (22.4cVa + Vb)
(7)(1分)在溶液中I2将SO2氧化的同时,原空气中的O2也能将SO2氧化而被吸收。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com