
1、1993年中美学者共同合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146个氢原子构成,关于此物质的下列说法中错误是
A、是烃类化合物 B、常温下呈固态 C、具有类似金刚石的硬度 D、能在空气中燃烧
30. (09扬州二模)为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
(09扬州二模)为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积

方案Ⅱ:铜铝混合物 测定剩余固体的质量
回答下列问题:
⑴小组成员一致认为两个方案都可行,你认为在实验室中选择方案 更便于实施。
⑵小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是 。(填编号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
⑶小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3·H2O溶液,使混合溶液的PH值不断升高,当加至溶液的体积为45 mL时Al3+开始反应生成成沉淀,当加至溶液的体积为50 mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)
[查阅资料]:常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,
Ksp[Cu(OH)2]=2.0×10-20mol·L-3。
①Al(OH)3开始析出时溶液的PH值?
②若溶液中离子的浓度约为1.0×10-5 mol·L-1时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?
29.(08扬州四模)粗盐提纯的研究。[有关资料]
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
4.96×10-9 |
4.96×10-9 |
2.34×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
 [设计除杂过程]
[设计除杂过程]
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是 。(2)混合液A的主要成分是 。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤一:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。A、Na2CO3 B、Na2SO3 C、Na2C2O4
[获取纯净食盐]
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到
时(填现象),停止加热。
[问题讨论]
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 ,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在 以下。
28.工业上制取CuCl2的生产流程如下:
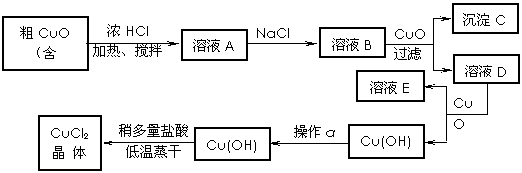
请结合下表数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
⑴ 溶液A中加入NaClO的目的是 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
27.已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是.
Mg(OH)2(固)
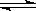 Mg2++2OH-……① NH4++H2O
Mg2++2OH-……① NH4++H2O
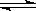 NH3·H2O+H+……②
NH3·H2O+H+……②
H++OH- 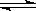 H2O……③
H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是.
Mg(OH)2(固)
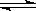 Mg2++2OH-……① NH4++OH-
Mg2++2OH-……① NH4++OH- 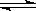 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由____________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式__________________________________。
26.某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5 Fe2+ +5C2O42-+3MnO4-+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
|
a/g |
起始读数/mL |
b/mL |
c/mL |
|
0.1970 |
0.00 |
31.30 |
42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42-)== ;
FeC2O4 的质量分数为 (精确到0.01%)
25.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。
 如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),理由是
。
如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),理由是
。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶
液导电能力与加入盐酸体积关系的曲线图(见右)。
①滴定管盛放盐酸前,要先用蒸馏水 ,再
用少量蒸馏水 ,再用 ,然后才
能盛放盐酸。滴定管中加入盐酸、排净 后,凹
液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③简述判断滴定中点的理由 。
④该氨水样品的物质的量浓度为 。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确”、“不正确”),理由是 。
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
24.常温下Ca(OH)2溶于水达饱和时存在如下平衡: Ca(OH)2(s) Ca(OH)2(aq),
Ca(OH)2(s) Ca(OH)2(aq),
Ca(OH)2(aq) Ca2++2OH- 饱和石灰水的密度为d
g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
A.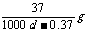 B.
B. C.
C. D.
D.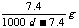
23.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下:
|
物质 |
AgCl |
AgI |
Ag2S |
|
颜色 |
白 |
黄 |
黑 |
|
KSP(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶度积相同
22.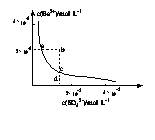 (镇江市09第二次调研测试)某温度时,BaSO4在水中的
(镇江市09第二次调研测试)某温度时,BaSO4在水中的
沉淀溶解平衡曲线如图所示。下列说法正确的是
A.加入Na2 SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com