
5.[常州国际学校09届高三化学综合测试 ]下列反应的离子方程式中,错误的是[B ]
A.硫化亚铁跟稀硫酸反应:FeS +2H+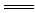 Fe2++ H2S↑
Fe2++ H2S↑
B.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+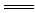 Ca2++2H2O+2CO2↑
Ca2++2H2O+2CO2↑
C.向硝酸亚铁溶液中加入稀盐酸:3Fe2++4H++NO3-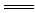 3Fe3++NO↑+2H2O
3Fe3++NO↑+2H2O
D.向澄清石灰水中滴加过量碳酸氢钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
4.[江苏常州市安家中学09届高三化学试卷]在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- (B)
③ Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
3.[江苏常州市安家中学09届高三化学试卷]能正确表示下列反应的离子方程式是 ( B)
A.醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+ H2O
B.碳酸氢钙与过量的NaOH溶液反应
Ca2++2HCO3-+2OH-=CaCO3↓+ 2H2O+ CO32-
C.苯酚钠溶液与二氧化碳反应 C6H5O-+ CO2+ H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4 H2O
1.[江苏省常州市第三中学2009届高三化学11月模拟试卷. ]在下述条件下,一定能大量共存的离子组是[C]
A.无色透明的水溶液中:K+、Ba2+、I-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.c (HCO3-)=0.1 mol·L-1的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、SO32-、Na+
|
A.用铂电极电解氯化镁溶液:Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-===BaSO4↓+H2O
C.在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+====2Mn2+ +5O2↑+8H2O
D.溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br
+OH-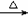 CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
3、 设计方案时需注意的问题。
(1)检查气体的纯度,点燃或加热通有可燃性(H2、CO、CH4、C2H4、C2H2等)的装置前,必须检查气体的纯度。例如用H2、CO等气体还原金属氧化物时,需要加热金属氧化物,在操作中,不能先加热,后通气,应当先通入气体,将装置内的空气排净后,检查气体是否纯净(验纯),待气体纯净后,再点燃酒精灯加热金属氧化物。
(2)加热操作先后顺序的选择。若气体发生需加热,应先用酒精灯加热发生气体的装置,等产生气体后,再给实验需要加热的固体物质加热,目的是:一则防止爆炸(如氢气还原氧化铜);二则保证产品纯度,防止反应物或生成物与空气中其他物质反应。例如用浓硫酸和甲酸共热产生CO,再用CO还原Fe2O3,实验时应首先点燃CO发生装置的酒精灯,生成的CO赶走空气后,再点加热Fe2O3的酒精灯,而熄灭酒精灯的顺序则相反,原因是:在还原性气体中冷却Fe可防止灼热的Fe再被空气中的O2的氧化,并防止石灰水倒吸。
(3)冷凝回流的问题。有的易挥发的液体反应物,为了避免反应物质损耗和充分利用原料,要在发生装置中设计冷凝回流装置。发在发生装置中安装长玻璃管等。
(4)冷却问题。有的实验为防止气体冷凝不充分而受损失,需要冷凝管可用冷水或冷水冷凝气体(物质蒸气),使物质蒸气冷凝为液态便于收集。
(5)防止倒吸问题。实验过程用到加热操作的,要防倒吸;气体易溶于水的要防倒吸。
(6)具有特殊作用的实验改进装置。如为防止分液漏斗中的液体不能顺利流出,用橡皮管连接成连通装置;为防止气体从长颈漏斗中逸出,可在发生装置中的漏斗末端套住一支小试管等。
(7)拆卸时的安全性和科学性。实验仪器的拆卸要注意安全性和科学性,有些实验为防止“爆炸”或“氧化”,应考虑停止加热或停止通气,如对有尾气吸收装置的实验,必须将尾气导管提出液面后才能熄灭酒精灯,以免造成溶液倒吸;用氢气还原氧化铜的实验应先熄灭加热氧化铜的酒精灯,同时继续通氢气,待加热区冷却后才停止通氢,这是为了避免空气倒吸入加热区使铜氧化,或形成易爆气体;拆卸用排水法收集需要的加热制取气体的装置时,需先把导管从水槽中取出,才能熄灭酒精灯,以防止水倒吸;拆下的仪器要清洗、干燥、归位。
试题枚举
[例1]实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色,易潮解,100℃左右时升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
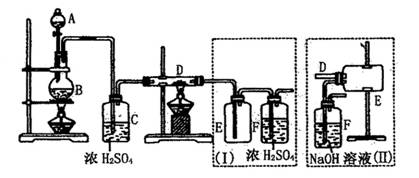
(1)B中反应的化学方程式为:_________________________________________。
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是: __________。
(3)D中反应化学方程式是: ________________________________ 。
(4)装置(Ⅰ)的主要缺点是: ________________________________________。
(5)装置(Ⅱ)的主要缺点是:____________________________________________。
如果选用此装置来完成实验,则必须采取的改进措施是:__________________。
解析 由题设“制备三氯化铁”可知D管中是铁丝或铁粉,并推知A、B、C应该是发生氯气的装置,A中加入浓盐酸,B中应该让浓盐酸跟氧化剂作用(常用的是MnO2或KMnO4)。
要使D管中空气排出,最方便的方法就是首先让刚发生的氯气去驱除它,此时D管中不要加热。等到空气驱净、氯气充满D管时才在D管下加热,以保证铁和纯氯气反应。由于氯化铁易升华,因此D管中FeCL3容易升华而出,却又特别容易重新冷凝,在装置Ⅰ中D管出口可能被堵塞,多余的氯气并不能被浓H2SO4吸收,排放尾气时将导致污染。而装置Ⅱ的D管出口是广口瓶,可免受堵塞,尾气排放前有碱液吸收,这都是好的。但FeCL3容易被潮解,碱液不足以抵挡湿气,应在E、F之间加入干燥装置。
 答案
(1)4HCl+MnO2=====MnCl2+2H2O+Cl2↑
答案
(1)4HCl+MnO2=====MnCl2+2H2O+Cl2↑
 或16HCl+2KMnO4======2KCl+2MnCl2+8H2O+5Cl2↑
或16HCl+2KMnO4======2KCl+2MnCl2+8H2O+5Cl2↑
(2)B中的反应进行一段时间后,看到黄绿色的气体充满装置,再开始加热D;
(3)2Fe+3Cl2======2FeCl3;
(4)导管易被产品堵塞,尾气排入空气,易造成环境污染;
(5) 产品易受潮解;在瓶E和F之间连接装有干燥剂的装置。
[例2]航天飞行器座舱内空气更新过程如图所示:
空气、CO2、H2O


|
|
|



 空气
空气
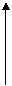
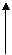

H2 H2O
O2 H2O


|

(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式_____________________。
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航中每天消耗28molO2,呼出23molCO2,则宇航员生天呼出的气体中含H2O________mol。
(3)以下是另一种将CO2转化为O2的实验设想:
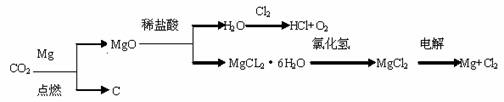
其中,由MgCl2·6H2O制取无水MgCL2的部分装置(铁架台、酒精灯已略)如下:
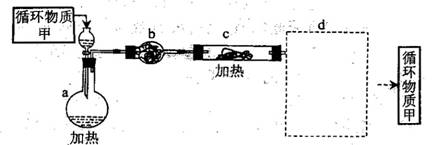
① 上图中,装置a由________、_________、双孔塞和导管组成。
② 循环物质的名称是______________
③ 制取无水氯化镁必须在氯化氢存在的条件下进行,原因是__________
④ 装置b是填充的物质可能是__________(填入编号)
e硅胶f、碱石灰 g、无水氯化钙 h、浓硫酸
⑤ 设计d中装置要注意防止倒吸,请在方框中画出d装置的简略图,并要求与装置c的出口处相连(铁架台不必画出)。
 解析 (1)Ⅱ中反应物是CO2和H2,生成物是C和H2O,配平后得:2H2O+CO2
2H2O+C
解析 (1)Ⅱ中反应物是CO2和H2,生成物是C和H2O,配平后得:2H2O+CO2
2H2O+C
(2)消耗28molO2呼出23molCO2,依质量守恒定律,呼出的气体中含H2O10mol时,氧原子守恒。
(3)由MgCL2·6H2O制取无水MgCL2时需在酸性条件下进行,在b处干燥时用中性或酸性固体干燥剂,硅胶或无水氯化钙,由于氯化氢极易溶于水,在d处为防止倒吸,用一倒扣的漏斗。
 答案 (1)2H2+CO2 2H2O+C
答案 (1)2H2+CO2 2H2O+C
(2)10
 (3)防止水解
(3)防止水解
(4)e、g
(5)
2、 设计方案时思考实验顺序的选择。
(1)思考问题的顺序:
①围绕主要问题思考,例如:选择适当的实验路线、方法;所用药品、仪器简单易得;实验过程快速、安全;实验现象明显。
②思考有关物质的制备、净化、吸收和存放等有关问题。例如:制取在空气中易水解的物质(如AL2S3、ALCl3、Mg3N2等)及易受潮的物质时,往往在装置末端再接一个干燥装置,以防止空气中水蒸气进入。
③思考实验的种类及如何合理地组装仪器,并将实验与课本实验比较、联系。例如涉及到气体的制取和处理,对这类实验的操作程序及装置的连接顺序大体可概括为:发生→除杂质→干燥→主体实验→尾气处理。
(2)仪器连接的顺序:
① 所用仪器是否恰当,所给仪器是全用还是选用。
② 仪器是否齐全。例如制有毒气体及涉及有毒气体的实验是否有尾气的吸收装置。
③ 安装顺序是否合理。例如:是否遵循“自下而上,从左到右”的原则;气体净化装置中不应先干燥,后又经过水溶液洗气。
④ 仪器间连接顺序是否正确。例如:洗气时“进气管长,出所气管短“;干燥管除杂质时”大进小出“等。
(3)实验操作的顺序:
① 连接仪器。按气体发生→除杂质→干燥→主体实验→尾气处理顺序连接好实验仪器。
② 检查气密性,在整套仪器连接完毕后,应先检查装置的气密性,然后装入药品。检查气密性的方法要依装置而定。
③ 装药品,进行实验操作。
1、 实验方案设计的一般原则。
一个相对完整的化学实验方案一般包括下述内容:(1)实验名称;(2)实验目的;(3)实验原理;(4)实验用品(仪器、药品及规格);(5)实验步骤(包括实验仪器的装配和操作);(6)实验现象和记录及结果处理;(7)问题和讨论。
实验方案的设计原则是方法简便、现象明显、操作易行,对于定量实验还要考虑系统误差要求。确定了实验所选用的方法和原理后,就要考虑选择用什么实验装置来完成此实验,即进行实验装置的设计,一套完整的实验装置往往是由多个基本实验装置相互连接而成的,如有关气体的制取和性质实验一般分为气体的发生装置(或气体反应装置)、气体的洗涤装置、气体的收集装置、尾气的吸收装置等部分,要熟悉各基本装置的功能,并注意各基本装置连接顺序的合理性。
² 利用给出的一些装好药品的单个实验装置,要求根据实验目的连接仪器,叙述现象说明理由。
² 利用给出的实验的装置和反应条件,要求根据实验现象和物质的性质判断物质和化学反应。
² 利用限定的仪器、药品、融气体制备、除杂、集气及设计操作程度、仪器连接、定量计算于一体。考查学生设计实验、基本操作和数据处理的能力。
² 给出部分实验环节,根据实验要求设计完整的实验或补充部分实验步骤。
² 据实验目的,实验进行的条件,选取适当药品、仪器(或应用所指定的药品、仪器)完全某次指定的实验操作。
² 对给出的实验方案,做出科学的评估,依据“仪器简单、操作方便、药品易得、节省试剂、现象明显、安全防污”选择出最佳方案。
² 新情境实验题,运用已有知识解决新情境中的新问题,考查学生灵活运用知识的迁移能力、自学能力、观察能力、实验能力和思维能力。
23、分子式与苯丙氨酸相同,且同时符合下列两个条件:①有带有两个取代基的苯环;②有一个硝基直接连在苯环上的异构体的数目是
A、3 B、5 C、6 D、10
22、某温度下,在200g饱和硫酸铜溶液中加放4g无水硫酸铜粉末,其结果是
A、析出6.25g蓝色晶体; B、溶质质量不变; C、溶液密度不变; D、溶液pH不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com