
8.用下列实验装置进行的实验能达到实验目的的是(CD)

7.下列实验操作中,仪器需插入液面以下的有 (C)
①制备Fe(OH)2时将NaOH溶液滴入FeSO4溶液中所用的胶头滴管 ②制取H2的简易装置中长颈漏斗的下端管口 ③分馏石油时控制温度所用的温度计 ④用乙醇制备乙烯时所用的温度计 ⑤用氨水吸收二氧化硫时的导气管 ⑥向试管中的BaCl2溶液中滴加稀H2SO4所用的胶头滴管
A.③⑤⑥ B.②④ C.①②④ D.①②③④⑤⑥
6.按下列过程,最终能够实现的是(BD)
A.Fe  FeCl2溶液
FeCl2溶液 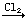 FeCl3溶液
FeCl3溶液  FeCl3晶体
FeCl3晶体
B.FeSO4溶液  Fe(OH)2
Fe(OH)2 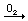 Fe(OH)3
Fe(OH)3 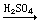 Fe2(SO4)3溶液
Fe2(SO4)3溶液  Fe2(SO4)3
Fe2(SO4)3
C.镀锌铁片  静置5min,刻痕处显红色
静置5min,刻痕处显红色
D.Cu 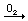 CuO
CuO
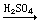 CuSO4溶液
CuSO4溶液  胆矾
胆矾
5.由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是(C )
A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1∶1∶3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1∶2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
4.向溴化铁溶液中加入足量新制氯水,将溶液蒸干充分灼烧,最后得到的固体是( A )
A.Fe2O3 B.FeCl3 C.FeCl3 和Br2 D. Fe(OH)3
3.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为( A )
A.Fe(OH)3 ;Fe2O3 B.Fe(OH)2 ;FeO
C.Fe(OH)2、Fe(OH)3 ;Fe3O4 D.Fe2O3 ;Fe(OH)3
2.某溶液中有NH4+、Mg2+、Fe2+和Al3+4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是( AC )
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
1.将FeCl3溶液加热蒸干之后灼烧,最后得到的固体物质是( C )
A.FeCl3 B.Fe(OH)3 C.Fe2O3 D.FeCl3和Fe2O3
|
1. 2. |
考点3:铁的氧化物和氢氧化物
[例1] 将nmol木炭粉和1mol氧化亚铁在反应容器中混合隔绝空气加强热,可能发生的化学反应有:①FeO+C高温====Fe+ CO↑ ②2FeO+C高温====2Fe+ CO↑
③FeO+CO高温====Fe+ CO2↑ ④CO2+C高温====2CO
(1)若n<1/4,充分反应后,反应器中的固体物质是FeO和Fe,气体产物是CO
(2)若n>4,充分反应后,反应器中的固体物质是C和Fe,气体产物是CO
(3)若反应的气体产物是混合物,n的取值范围是 1/2<n<1 。
(4)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为
2/3。
[感悟]:
[例2] 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1摩,在此溶液中加入90毫升4摩/升的NaOH溶液,使其充分反应。设Al3+物质的量与总物质的量的比值为x。
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围。
(3)若Al3+和Fe3+物质的量之和为A摩(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
(1)n(OH-)过量(可计算),有0.06摩Fe(OH)3沉淀
(2)的最大取值为 0.1(1-x)×3+0.4x=0.09×4,x=0.6
∴在0≤x≤0.6时,沉淀只有Fe(OH)3
x=0时,Fe(OH)3沉淀量为0.1摩, x=0.4时,Fe(OH)3沉淀量为0.06摩,
x=0.6时,Fe(OH)3沉淀量为0.04摩, 在0.6≤x≤1内,总沉淀量:n总=0.1(1-x)+0.1x=0.04摩
(3)( 0.36/A -3) < X ≤ 1
[感悟]:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com