
5、太阳黑子活动的平均周期约为
A、10年 B、11年 C、22年 D、76年
4、地球上具有存在生命物质的条件是
①有液态水存在 ②地球是九大行星中距太阳最近的天体 ③有固体外壳 ④有适于生物呼吸的大气 ⑤大、小行星各行其道,互不干扰 ⑥地球处于不断的运动之中
A、 ①③④⑥ B、①④⑥ C、②④⑤ D、③④⑥
3、距离地球最近的自然天体是
A、牛郎星 B、太阳 C、月球 D、水星
2、关于太阳系九大行星的正确叙述是
A、水星距日最近,质量最小 B、地球自转和公转的周期都是最长的
C、木星体积最大 D、 冥王星永远距日最远
1、天体的正确定义是
A、宇宙间日月星辰的总称 B、肉眼所见到的所有星体
C、天球上的所有星体 D、宇宙间各种星体和星际物质的通称。
(2)月相变化的规律:
|
月相名称 |
出现的大致时间(农历) |
夜晚所见形状 |
日地月三者的位置关系 |
海洋潮汐 |
|
新月或朔 |
初一,不可见 |
不可见 |
三者在同一直线,月球居中 |
大潮 |
|
上弦月 |
初七、初八、上半夜 |
半圆,见于西半部天空,月面朝西 |
三者呈直角,月球在太阳以东 |
小潮 |
|
满月 |
十五、十六,通宵可见 |
一轮明月,东升西落 |
三者在同一直线,地球居中 |
大潮 |
|
下弦月 |
二十二、二十三、下半夜 |
半圆,见于东半部天空,月面朝东 |
三者呈直角,月球在太阳以西 |
小潮 |
由此可见,北半球中纬度地区,上半月(从朔到望),月亮的亮面朝向观测者的左边,即在夜晚观测时,亮面朝西,且随着时间的推移,从朔到望,亮面越来越大。下半月(从望到朔),月亮的亮面朝向观测者的右边,即在夜晚观测时,亮面朝东,且随时间的推移,亮面越来越小。
(3)对月相的利用:一方面可利用月相变化的周期计时:阴历或农历月即以月相变化为基础,朔望两弦四相,每相大约相隔7日,星期由此演变而来;另一方面利用月相可辩别方向,如前所述,上弦月西边亮,下弦月东边亮,由此可根据月面亮面的朝向来确定地面上的方向。
例:写出与下列诗句相应的月相
A.月落乌啼霜满天,江枫渔火对愁眠,姑苏城外寒山寺,夜半钟声到客船。(上弦)
B.月皎惊鸟栖不定,更漏将阑牵金井,唤起两眸清炯炯,泪花落枕红棉冷。(满月)
5、人类对宇宙的新探索
(1)宇宙探测的发展。1957年10月原苏联第一颗人造卫星上天开创了从太空观测研究地球和整个宇宙的新时代,1981年第一架航天飞机试航成功,人类从空间探索逐步进入空间开发阶段。1970年第一颗人造卫星“东方红”1号发射成功。注意热点:“神五”、“神六”的成功发射的有关内容。
(2)宇宙资源的类型
①空间资源:获取外空间信息、做科学实验。 ②太阳能资源 ③矿产资源
(3)宇宙空间开发国际化。
(4)宇宙中垃圾的产生、危害及处理办法。
[能力训练]
19.(09海门一检)短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)D原子结构示意图为____________;B和C形成的化合物电子式为___________;
(2)B和D简单离子的半径大小为________________;(用离子符号和“>”、“=”或“<”表示)
(3)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
①比较两种单质的颜色 ②比较氢化物的稳定性
③依据两元素在周期表的位置 ④比较原子半径大小
⑤比较最高价氧化物对应水合物的酸性
(4)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为___________________。
.(10分)(每空2分) (1) ;
;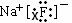 ;(2)r(F-)>r(Al3+);(3)①⑤;(4)
;(2)r(F-)>r(Al3+);(3)①⑤;(4)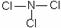
18.(08海南卷)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_____、_______; 杂化轨道分别是________、_________;a分子的立体结构是____________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是_______晶体、_______晶体:
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________;
(4)Y与Z比较,电负性较大的____________, 其+2价离子的核外电子排布式是_________。
17.(08宁夏卷)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
答案:(1)S C
(2)V形;直线形;SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大。
(3)Cr;四;1s22s22p63s23p63d54s1;+6。
(4)F-H…F F-H…O O-H…F O-H…O。
15.(08四川卷)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是________,写出该元素的任意3种含氧酸的化学式:_______________________。
(3)D和形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属_______________,其晶体类型属_____________________。
(5)金属镁和E的单质在高温下反应得到的产物是________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低并说明理由_______________________________________。
解析:由已知条件可推知:D为C,E为N,X为Si,Y为S,Z为Cl。
答案:(1)SO3。
(2)Cl;HClO、HClO2、HClO3、HClO4。
(3)直线型。
(4)共价键;原子晶体。
(5)Mg3N2;Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑。
(6)D的最高价氧化物为CO2,X的最高价氧化物为SiO2,前者比后者的熔点低,因为前者为分子晶体,由分子间的作用力结合,而后者为原子晶体,由共价键结合,共价键之间的作用力远大于分子间的作用力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com