
6.反应热及热化学反应方程式的书写:
①反应过程中放出或吸收的热量,均属于反应热。
②表示化学反应吸收或放出热量的方程式,是热化学方程式。
③热化学方程式的特点。
A.必须注明各种物质的聚集状态。
B.在方程式右边注明热量的数值与符号。
C.分子式前面的系数可用分数,且必须与标明的热量相对应
D.热化学方程式之间可以叠加或叠减。
④盖斯定律:一个化学反应,无论是一步完成还是分步完成,整个过程的热效应是相同的。
5.物质的量浓度及其计算。
①物质的量浓度:用1L溶液中含有多少物质的量的溶质来表示的溶液浓度。其单位是:mol/ L.
②同一溶液,只要条件相同,无论取出多少体积,其浓度不变。
③物质的量浓度与溶质质量分数的换算,溶解度的换算,必须知道溶液的密度。
④溶液稀释与混合的共同特点是:溶质的质量或溶质的物质的量保持不变。当溶液的浓度非 常小,其体积可以认为是混合前的体积的加和;当溶液的浓度较大时,其体积应根据溶液的密度和溶液质量求出体积。
⑤气体溶于水,求所得溶液的物质的量浓度,关键是求溶液的体积。必须根据溶液的密度和溶液质量求出体积。
4.阿佛加德罗定律及其应用
①阿佛加德罗定律:同温同压下,同体积的任何气体都会有相同数目的分子。
②阿佛加德罗定律的适用范围:气体或有气体参加的化学反应。
③阿佛加德罗定律的推论:
A.由三同推一同。
B.联系理想气体状态方程PV=nRT,可以得出一系列正比、反比关系。
3.气体摩尔体积及其计算
在标准状况下,1mol任何气体所占的体积。其值大约是22.4L,单位:L/mol。
①不是“摩尔体积”,而是“气体摩尔体积。”
固体、液体物质的体积主要取决于原子、分子、离子本身的大小;而气体物质的体积主要取决于分子间的平均距离。与气体物质的条件有关。
②标准状况:1atm 0℃。
2.平均分子量、平均摩尔质量、相对密度及其计算。
①平均分子量:对组成一定的混合物而言,可根据各组分的组成和分子量来计算平均分子量。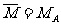 ·a%+MB·b%+…
·a%+MB·b%+…
②平均摩尔质量在数值上等于平均分子量。
③相对密度:D=MA/MB
1.摩尔及其计算
摩尔是物质的量的单位,每摩尔物质含有阿佛加德罗常数个微粒。
①物质的量:是一个特定的物理量。单位是摩尔。
②阿佛加德罗常数:12g12C所含有的C原子数,是一个确定常数,一般用NA表示,近似值为6.02×1023。
③微粒:即微观粒子,包括原子、离子、电子、质子、中子,所以,摩尔只能是微粒的单位,不能用来表示宏观物质。
3.掌握有关原子量、分子量,有关物质的量,有关气体摩尔体积,有关物质溶解度,有关溶液浓度(质量分数和物质的量浓度)的计算。
2.掌握物质的量、摩尔质量、物质的量浓度、气体摩尔体积的涵义。理解阿佛加德罗常数的涵义。掌握物质的量与微粒(原子、分子、离子等)数目,气体体积(标准状况下)之间的相互关系。
1.理解原子量(相对原子质量),分子量(相对分子质量)的涵义。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com