
1、了解非金属原子核外电子排布的周期性与元素性质递变关系,掌握典型非金属硅元素在元素周期表中的位置及性质的关系;
1(2007全国卷II) 9.已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量
②①1molCl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl(g)=2HCl(g)
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
2(2007全国卷山东考题)12.下列叙述正确的是
A.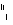 O2和
O2和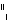 O2互为同位素,性质相似
O2互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s) ΔH>0,所以石墨比金刚石稳定
3(2007全国卷广东考题 )16灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)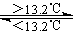 Sn(s、白)
△H3=+2.1kJ/mol
Sn(s、白)
△H3=+2.1kJ/mol
下列说法正确的是
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
4(2007全国卷广东考题 )19下列说法正确的是
A 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
5(2007全国高考上海卷)14已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)+2878kJ
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)+2869kJ
下列说法正确的是
A 正丁烷分子储存的能量大于异丁烷分子
B 正丁烷的稳定性大于异丁烷
C 异丁烷转化为正丁烷的过程是一个放热过程
D 异丁烷分子中的碳氢键比正丁烷的多
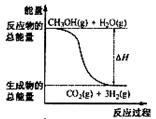 6(2007全国高考江苏卷 )7.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
6(2007全国高考江苏卷 )7.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
7(2007全国卷重庆考题)13.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且氧气中1 mol O=O键完全断裂时吸收热量496 Kj,水蒸气中1 mol H-O键形成时放出热量463 Kj,则氢气中1 mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ
C. 436 kJ D.188 kJ
18.取0.45mol NaOH,0.35mol Na2CO3和0.20mol NaHCO3溶解于水,在该混合物溶液中加入盐酸,反应物明 显分三个阶段进行。若加入的盐酸n mol,溶液中NaCl、Na2CO3和NaHCO3分别为X mol、Y mol、Z mol,试分别计算在n值增大的过程中,不同反应阶段的n值范围和所对应的X、Y 、Z的值,将其计算结果填入下表。
|
加入HCl n(mol) |
溶液中NaCl X(mol) |
溶液中Na2CO3 Y(mol) |
溶液中NaHCO 3 Z(mol) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
知识点:本题是一道信息试题,考查物质的量的计算能力点:培养学生分析问题和解决问 题的能力。
17.水在自然净化中,要把有机污染物自发地氧化转变为简单的无机物质。1L水中含有机物 转化为无机物所需要的氧气数量称为生化需氧量(BOD),其单位用(g/L)表示。
某地区一条污水河,测定其中含0.0010%的有机物(该有机物的分子式以C6H10O5表示)。已知20℃、常压下,氧气在纯水中的溶解度为0.0092g/L;鱼在含氧量小于0.004g/L 的水中不能生存。
(1)计算此条河中的BOD;
(2)判断此条河中的鱼能否生存。
知识点:本题是一道信息题,涉及到数学计算,物质的量浓度的计算。
能力点:培养学生利用已学过的知识解决实际问题的能力。
15.有一包固体混合物中含有KNO3和不溶性杂质,加入一定量的水充分溶解,其结果如下表:
表一:
|
温度(℃) |
10 |
40 |
75 |
|
剩余固体(g) |
261 |
175 |
82 |
表二:
|
温度(℃) |
10 |
40 |
50 |
55 |
60 |
65 |
75 |
80 |
|
KNO3的溶解度(g) |
20.9 |
63.9 |
85.5 |
95 |
110 |
126 |
150 |
169 |
(1)通过计算可知用水的质量为多少g?
(2)原固体混合物中含KNO3的质量为多少g?
(3)若要完全溶解此固体混合物中的KNO3,所需最低温度是多少?
知识点:本题考查有关溶解度和有关计算能力点:培养学生自学能力。
14.在一密闭气缸内,用一不漏气可滑动的活塞隔开(如图)。左边充有N2,右边充有H2 和O2。在室温下,将右边的混合气点燃反应后冷却到原室温,活塞最终都落在气缸的中点 (水的体积可忽略不计)。求原来H2和O2的体积比是多少?
反应前:
|
N2 |
H2 O2 |
1 3
反应后:
|
N2` |
剩余气 |
2 2
知识点:本题考查阿佛加德罗定律的有关内容能力点:培养学生抽象思维能力。
13.实验室要配制含0.17mol K2SO4,0.16mol KCl,0.5 mol NaCl的溶液1L。现因无K 2SO4,只有Na2SO4,KCl,NaCl,问如何配制所需溶液?简述操作步骤。( )
知识点:本题考查关于物质的量浓度的有关计算,配制等内容
能力点:培养学生实验能力和计算能力。
12.环境监测测定水中溶解O2方法是:量取a mL水样,迅速加MnSO4溶液及含有NaOH的KI 溶液,立即塞好塞子,振荡使混合均匀。开塞,迅速加入行之有效量H2SO4,此时有I2生成。用Na2S2O3溶液(浓度为b mol/L)和I2反应,消耗了V mL(以淀粉为指示剂) ,有关反应方程式为:2Mn2++O2+4OH- 2MnO(OH)2(反应很快);
2MnO(OH)2(反应很快);
MnO(OH)2+2I-+4H Mn2++I2+3H2O I2+2S2O32-
Mn2++I2+3H2O I2+2S2O32- 2I-+S4O62-。
2I-+S4O62-。
(1)水中溶解O2的量(以mol/L为单位)为 ;
(2)I2和S2O32-反应以淀粉为指示剂,达终点时溶液颜色变化如何?
;
(3)加MnSO4溶液及含有NaOH的KI溶液后振荡时,若塞子未塞紧(设振荡时未溅出溶液),将 对测定结果有何影响?为什么?
(4)开塞到加H2SO4前的时间间隔很长,测定结果又如何?说明理由。
知识点:本题是一个关于物质的量结合离子反应方程式的计算试题
能力点:培养学生逻辑思维能力及计算能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com