

8.(09年广东化学·24)(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超Al2O3,NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mlPH为2浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g。
②将上述固体置于烧杯中 。
(3)在0.1mol·l-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液ph变化的关系见下图
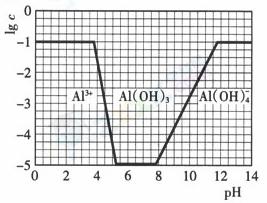
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有 ②请在答题卡的框图中,画出0.01mol·l-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要的标注。
答案:(1)2NH4AlO(OH)HCO3 2NH3↑+Al2O3+3H2O↑+2CO2↑(2)将4.5g固体置于烧杯中,边加蒸馏水溶解边用玻璃棒搅拌,待完全溶解后,用玻璃棒移液至100ml的容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中,加蒸馏水至刻度线2~3cm处应改用胶头滴管,上下振荡,静置,将配置好的溶液装入试剂瓶中,并贴上标签。
2NH3↑+Al2O3+3H2O↑+2CO2↑(2)将4.5g固体置于烧杯中,边加蒸馏水溶解边用玻璃棒搅拌,待完全溶解后,用玻璃棒移液至100ml的容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中,加蒸馏水至刻度线2~3cm处应改用胶头滴管,上下振荡,静置,将配置好的溶液装入试剂瓶中,并贴上标签。
(3)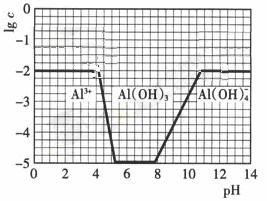 。作图要点:起始与最终数值为-2;刚开始产生沉淀时PH要增大;完全沉淀和沉淀溶解时的PH应与原图一样;氢氧化铝完全溶解时的PH也是不变的二纵座标发生改变,所以线要与原图有所区别。
。作图要点:起始与最终数值为-2;刚开始产生沉淀时PH要增大;完全沉淀和沉淀溶解时的PH应与原图一样;氢氧化铝完全溶解时的PH也是不变的二纵座标发生改变,所以线要与原图有所区别。
解析:(1)解答该题的关键是要判断出反应的产物,由题意NH4AlO(OH)HCO3热分解的产物应该有Al2O3,结合所学知识可知产物还应有NH3、CO2和H2O,配平化学方程式得:2NH4AlO(OH)HCO3 2NH3↑+Al2O3+3H2O↑+2CO2↑
2NH3↑+Al2O3+3H2O↑+2CO2↑
(2)注意配置一定物质的量浓度溶液的操作步骤地准确性,一般是计算、溶解、转移、洗涤、定容、装瓶。计算时要注意规范,同时要注意托盘天平的精确度是±0.1g,100ml 0.1mol/LNH4Al(SO4)2中,物质的量为0.01mol,M[NH4Al(SO4)2]=453g/mol ,所以m(NH4Al(SO4)2)=453g/mol×0.01mol=4.53g=4.5g;溶解时要注意玻璃棒搅拌,转移时注意用到玻璃棒引流,同时还要注意洗涤操作,定容时距刻度2~3cm处应改用胶头滴管,同时还要注意上下震荡,使之混合均匀,装瓶时要注意贴上标签。
(3)①从题给图示可以看出,pH至7时铝离子完全转化为氢氧化铝沉淀,没有出现沉淀的溶解,又因为铵根离子水解使溶液显酸性,所以中性溶液中必须是铵根离子和一水合氨的混合物,说明必需有铵根离子与氢氧根的反应。该过程中发生反应的离子方程式为:Al3+ +3OH-===Al(OH)3↓;NH4+ +OH-=NH3·H2O②作图时注意NH4Al(SO4)2浓度的变化,由于浓度变为0.01mol·l-1,所以起始与最终数值为-2,又因为Al3+浓度减少减少为0.01mol·l-1,而溶度积常数不变,所以刚开始产生沉淀时pH要增大。而完全沉淀和沉淀溶解时的PH应与原图一样不能改变,但注意氢氧化铝完全溶解时的PH也是不变的二纵座标发生改变,所以线要与原图有所区别。
7.


 (09年广东化学·22)(12分)
(09年广东化学·22)(12分)
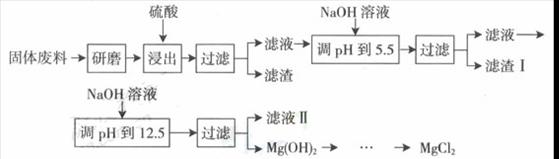
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
pH |
3.4 |
5.2 |
12.4 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)
(2)滤渣I的主要成分有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
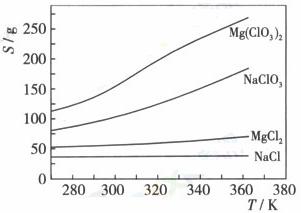
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
答案:(1)增大硫酸浓度;加热升高温度;边加硫酸边搅拌(要求写出两条)
(2)滤渣Ⅰ主要成分有Fe(OH)3、Al(OH)3
(3)从滤液Ⅱ中可回收利用的主要物质有CaSO4、Na2SO4
(4)①该反应的生成物为Mg(ClO3)2和NaCl的混合溶液,NaCl的溶解度随温度变化不大,Mg(ClO3)2的溶解度随温度升高而升高。利用两物的溶解度差异,通过加热蒸发浓缩,冷却结晶,过滤,将Mg(ClO3)2与NaCl分离,制得Mg(ClO3)2。
②因为在相同温度向下NaCl的溶解度最小,所以在冷却结晶过程中,会有少量NaCl随Mg(ClO3)2析出;重结晶。
解析:(1)固体溶解及反应完全的措施一般是加热、振荡或搅拌,或是增大硫酸的浓度,所以答案应该从这些方面分析回答。
(2)从题给信息可以看出pH调到5.5应该Fe3+和Al3+沉淀完全,所以沉淀应该是氢氧化铁和氢氧化铝。
(3)从流程变化,因为废料浸出用到硫酸,可知滤液中应该含有硫酸根离子;从废料成分中含有CaMg(CO3)2和两次调节PH均用到氢氧化钠,可知滤液中阳离子应该有钠离子和钙离子,所以从滤渣Ⅱ中可回收利用的主要物质是硫酸钠和硫酸钙。
(4)①分析该题可以结合硝酸钾与氯化钠的分离方法思考,同时要注意题给图示,从图示上我们不难得到下列信息,一是相同温度时氯酸镁的溶解度最大氯化钠溶解度最小,二是氯酸镁溶解度随温度变化最大,氯化钠溶解度随温度变化最小。所以控制反应温度的变化,可以控制可溶性物质的分离。
②从题给图示不难看出相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠。由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离。
6. (09年海南化学·20.4)(11分)
(09年海南化学·20.4)(11分)
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为
:
(1)氨催化氧化的化学方程式为
:
 (2)原料气中空气必须过量,其主要原因是
;
(2)原料气中空气必须过量,其主要原因是
;
 (3)将铂铑合金做成薄丝网的主要原因是
;
(3)将铂铑合金做成薄丝网的主要原因是
;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
答案:(11分)
(1)4NH3+5O2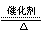 4NO+6H2O
4NO+6H2O (3分)
(3分)
 (2)提高氨的转化率和一氧化氮的转化率(2分)
(2)提高氨的转化率和一氧化氮的转化率(2分)
 (3)增大单位质量的催化剂与反应物的接触面积(2分)
(3)增大单位质量的催化剂与反应物的接触面积(2分)
 (4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
(4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
解析:(1)
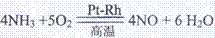
(2)根据平衡原理,增大反应物的浓度,平衡向正反应方向移动,以提高原料的转化率;
(3)这是为了增大铂铑合金的表面积,使接触面积增大,提升催化的效果;
(4)为了提高吸收率,可根据溶解过程放热采用降温处理,且气体的吸收可用加压的方式。
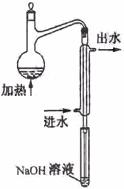
5.(10分)(08年江苏化学·15)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子M(CN)nm-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
 Ag++2CN - == [Ag(CN)2]
-
Ag++2CN - == [Ag(CN)2]
-
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
(1)水样预处理的目的是 。
(2)水样预处理的装置如右图,细导管插入吸收液中是为了
。
(3)蒸馏瓶比吸收液面要高出很多,其目的是 。
(4)如果用盐酸代替磷酸进行预处理,实验结果将
(填“偏高”、“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.01000 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为 mg·L-1的(以计,计算结果保留一位小数)。
答案:(10分)(1)将含氰化合物全部转化为CN - (2)完全吸收HCN,防止气体放空 (3)防止倒吸 (4)偏高 (5)109.2
解析:水样预处理的目的是,将污水中含的氰化合物HCN、CN -和金属离子的配离子M(CN)nm-的形式全部转化成HCN,然后用NaOH溶液吸收将HCN全部转化为CN -,很明显将细导管插入吸收液中是为了充分吸收HCN,防止气体排到空气中,引起大气污染,但同时可能产生倒吸现象,为防止倒吸,可以将蒸馏瓶升至比吸收液面要高出很多。如果用盐酸代替磷酸进行预处理,用AgNO3标准溶液滴定时,氯离子也消耗银离子,实验结果将偏高。
4.(8分)(08年山东理综·31)[化学--化学与技术]
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在__________部分发生反应,在 __________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为_________;加入硅、锰和铝的目的是_________。
(3)不锈钢含有的Cr元索是在炼钢过程的氧吹_________(填“前”或“后”)加入,原因是 _______________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
答案:
(1)炉身 炉腰
(2)2P+5FeO+3CaO
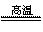 Ca3(PO4)2+5Fe 脱氧和调整钢的成分
Ca3(PO4)2+5Fe 脱氧和调整钢的成分
(3)后 避免Cr被氧化(或“氧吹前加入Cr会形成炉渣被除去”)
(4)CO 燃料(或还原剂)
3.(11分)(08年海南化学·29)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
|
序号 |
内容 |
实验现象 |
|
1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
|
2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
|
3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
|
4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
|
5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
|
6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) ;在电化学腐蚀中,负极反应是 ;正极反应是 。
(2)由该实验可知,可以影响铁锈蚀速率的因素是 。
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法)。
答案:(11分)(1)3、4、5、6 Fe-2e-=Fe2+(或2Fe-4e-=2Fe2+) O2+4e-+2H2O=4OH-
(2)湿度、温度、O2的浓度、电解质存在 (3)电镀、发蓝等表面覆盖层,牺牲阳极的阴极保护法等(其他合理答案也给分)
解析:工业上铁的锈蚀主要是电化学腐蚀,发生电化学腐蚀的条件是:活性不同的两极材料,电解质溶液,形成闭合回路。影响锈蚀速度的因素有:环境的温度、湿度、电解质存在、O2的浓度等。实验条件为有氧,为吸氧腐蚀:
负极:Fe-2e→Fe2+ 正极:O2+2H2O+4e→4OH-
保护钢铁不被腐蚀的措施
①外加保护层如:涂漆、搪瓷、电镀、表面钝化、油脂等。
②改变钢铁的内部结构,冶炼不锈钢。
③在钢铁的表面镶嵌比铁活泼的金属如锌,使活泼金属被氧化,而钢铁被保护。
34.[化学--选修化学与技术](15分)
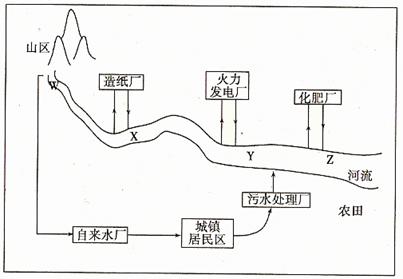
(1)①造纸厂排放的碱性污水使X处河水pH升高,火力发电厂净化烟气的酸性废水治理未达标就排放,造成Y处等的河水,pH降低(或火力发电厂燃烧产生的SO2会导致酸雨,飘落后使Y处等的河水pH降低)
②化肥厂、农田及生活污水使Z处河水富营养化,水温较高,适于藻类等水生植物生长,河水中溶解氧被大量消耗,导致鱼类死亡
(2)①发电厂 焦化厂 炼铁厂 水泥厂
②Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
CaCO3+SiO2
 CaSiO3+CO2↑
CaSiO3+CO2↑
③
用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料
用发电厂的煤矸石和粉煤灰作为水泥厂的原料
将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂烯煤时产生的SO2,减少对空气的污染建立污水处理系统
解析:A为发电厂,因为发电需要煤炭,且其为另外三厂提供电能,B为焦化厂,C的原料为赤铁矿和碳酸钙,碳酸钙可提供二氧化碳,制造水泥需要粘土。造纸厂排放的碱性污水使X处河水pH升高,火力发电厂净化烟气的酸性废水治理未达标就排放,造成Y处等的河水,pH降低(或火力发电厂燃烧产生的SO2会导致酸雨,飘落后使Y处等的河水pH降低),化肥厂、农田及生活污水使Z处河水富营养化,水温较高,适于藻类等水生植物生长,河水中溶解氧被大量消耗,导致鱼类死亡
2.[化学--选修化学与技术](15分)(08年宁夏理综·34)
分析下面两个案例并回答有关问题。
(1)某城镇生产、生活的分布情况如图所示,河流中W、X、Y、Z处某次水样抽测结果如表所示。
|
地点 项目 |
W |
X |
Y |
Z |
|
水温/℃ |
15 |
18 |
26 |
25 |
|
pH |
6 |
8 |
5 |
5 |
|
溶解氧量/(mg·L-1) |
11 |
9 |
7 |
3 |
①导致X、Y处水样pH变化的原因可能是 ;
②Z处鱼类大量减少,产生这种现象的原因可能是 。
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
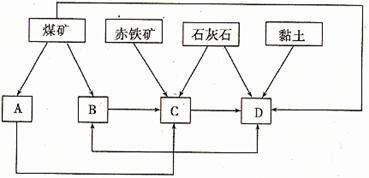
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定上图中相应工厂的名称A 、B 、C 、D ;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式 ;
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出2种措施即可) 。
9.8×109g x y
则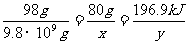 ,解得x=8.0×103t y=9.83×109kJ。
,解得x=8.0×103t y=9.83×109kJ。
1.(07年宁夏理综·31A)化学选考题(15分)A.[化学-选修化学与技术]
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%);
 |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1) 已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
答案:(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应。(2)增大压强对提高SO2转化率无显著影响,反而会增加成本。(3)否 否 (4)浓硫酸 (5)8.0×103t 9.83×109kJ
解析:(1)根据表格中的数据可以看出,在相同压强下(如在0.1MPa下)升高温度(如由400℃升高到500℃)时SO2的转化率降低(由99.2%降低为93.5%),即升高温度时此化学平衡向逆反应方向移动,而升高温度化学平衡应该向吸热反应方向移动,所以此反应的正反应为放热反应。
(2)根据表格中的数据可以得知:在0.1MPa(即常压1atm下)SO2的转化率已经很高,如在400℃时已达99.2%,若增大压强到10MPa(即100atm),压强增大了100倍但是SO2的转化率值增大为99.9%,只增大了0.7%变化不大。而压强增大100倍,需要对设备的材料、动力、能源等都作相应的提高,既要增大成本投入。
(3)使用催化剂只能改变化学反应的速率,改变反应到达平衡的时间,不能使化学平衡发生移动,即对SO2的转化率不产生影响;而在一定条件下,化学反应放出的热量与参加反应的反应物的量成正比,因SO2的转化率不变,所以反应放出的热量也不会增大。
(4)在生产实际中是采用98.3%的浓硫酸作吸收剂来吸收SO3的。因为若用水进行吸收会形成酸雾,将影响SO3的吸收速率和效率。
(5)1万吨98%的硫酸含H2SO4的质量:9.8×109g。 设需要SO3的质量为x,该反应产生的热量为y。
H2SO4 - SO3 - 放出的热量
98g 80g 196.9kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com