
2.(2007年西城理综)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中错误的是[B]
A.Y的气态氢化物的稳定性较Z的强 B.原子半径:W>Z>Y>X
C.W的最高价氧化物对应水化物的酸性较Z的强 D.四种元素的单质中,Z的熔、沸点最高
1.(2008·上海)化学科学需要借助化学专用语言描述,下列有关化学用语正确的是[B]
A.CO2的电子式 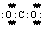 B.Cl-的结构示意图
B.Cl-的结构示意图 
C.乙烯的结构简式 C2H4 D.质量数为37的氯原子 17 37Cl
|
X |
Y |
|
|
|
Z |
W |
6、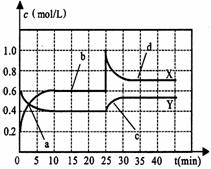 (温州市十校联合体高三联考)(6分)已知NO2和N2O4可以相互转化:2NO2
(温州市十校联合体高三联考)(6分)已知NO2和N2O4可以相互转化:2NO2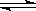 N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。根据右图,回答下列问题:
N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。根据右图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表
示NO2浓度随时间的变化;a、b、c、d四个点
中,表示化学反应处于平衡状态的点是 。
(2)前10min内用NO2表示的化学反应速率
v(NO2) = mol/(L·min);反应进行至25min
时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25min
时还可以采取的措施是 。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
4.(浙江淳安县08届高三上学期三校联考)在密闭容器中发生如下反应:aX(g)+bY(g)  cZ(g)+dW(g),反应达平衡后保持温
cZ(g)+dW(g),反应达平衡后保持温
度不变,将气体体积压缩到原来的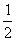 ,当再次达平衡时,W的浓度为原平衡时的1.8倍.下
,当再次达平衡时,W的浓度为原平衡时的1.8倍.下
列叙述中不正确的是 ( c )
A.平衡向逆反应方向移动 B.a+b<c+d
C.z的体积分数增加 D.X的转化率下降
5(浙江淳安县08届高三上学期三校联考)气态可逆反应mA(g)+nB(g)  pC(g)+qD(g),符合下图,试用“>”或“<”填(1)-(3)题.
pC(g)+qD(g),符合下图,试用“>”或“<”填(1)-(3)题.
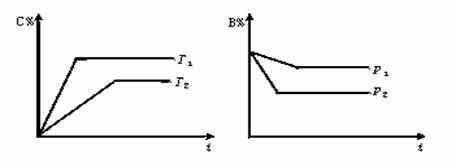
(1)、温度T1 ▲ T2.
(2)、压强p1 ▲ p2.
(3)、m+n ▲ p+q.
(4)、正反应为 ▲ 反应(填“放热”或“吸热”).
Da’an(1)> (2)< (3) > (4)吸热 (每空2分)
3.(温州市高三第二次“八校联考”)在某一容积为2 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:
CO(g) +H2O (g) 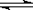 CO2(g) + H2(g);ΔH= a kJ/mol(a>0)
CO2(g) + H2(g);ΔH= a kJ/mol(a>0)
反应达到平衡后,测得c(CO):c(CO2)= 3:2。下列说法正确的是
A.反应放出的热量为0.2 a kJ
B.平衡时H2O 的转化率为40%
C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动
D.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
2.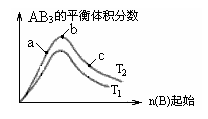 (2008年杭州学军中学高考模拟测试5月)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
(2008年杭州学军中学高考模拟测试5月)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.正反应一定是吸热反应,且T2>T1
D.b点时,平衡体系中A、B原子数之比接近1∶3
1.在容积不变的密闭容器中进行反应:2SO2 ( g )+O2( g)  2SO3(g ) ;△H < O 。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g ) ;△H < O 。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
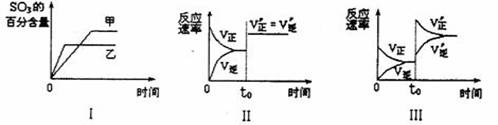
A .图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 B .图Ⅱ表示t0时刻使用催化剂对反应速率的形响 C .图Ⅱ表示t0时刻通人氦气对反应速率的影响 D .图Ⅲ表示与t0时刻增大O2的浓度对反应速率的形响
23、某溶液中可能含有I-、Cl-、Fe3+、SO32-,向该溶液中加溴水,溶液无色。因此可知原溶液中:
A、肯定不含I- B、肯定不含Cl- C、肯定含Fe3+ D、肯定不含有SO32-
22、某化工厂排放的酸性废液中含有游离的氯。要除去游离氯并中和其酸性,正确方案是
A、先加适量的Na2SO3,再加适量的NaOH; B、先加适量的NaOH;再加适量的Na2SO3,
C、先加过量的Na2SO3,再加适量的NaOH; D、先加过量的NaOH,再加适量的HCl;
21、下列现象不能用胶体知识解释的是
A、牛油与NaOH溶液共煮,向反应后所得溶液中加入食盐,会有固体析出;
B、一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞;
C、向FeCl3溶液中加入Na2CO3溶液,会出现红褐色沉淀;
D、在河水与海水的交界处,有三角洲形成。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com