
12. (09海淀区高三期中) 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
答案:
(1) 3 Cu2O
+14 H+ + 2  = 6 Cu2+ + 2 NO↑ + 7 H2O
= 6 Cu2+ + 2 NO↑ + 7 H2O
(2) 16 g
(3) 0.1 mol
(4) 0.05<n<0.15
11. (江苏省口岸中学2009届高三年级第二次月考化学试题)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管已部分变质的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
|
盐酸体积(mL) |
8 |
15 |
20 |
50 |
x |
120 |
150 |
|
生成CO2体积(mL) |
0 |
112 |
224 |
896 |
2240 |
2240 |
2240 |
试求:
 (1)当加入盐酸后,生成CO2体积不再增加时,x的最小值为
。
(1)当加入盐酸后,生成CO2体积不再增加时,x的最小值为
。
(2)未变质前NaHCO3的质量。
(3)部分变质后样品A中的成分及各成分的物质的量。
答案
. (1)110 (3分)
(2)滴加盐酸15 mL至20 mL时,NaHCO3+HCl=NaCl+H2O +CO2 ↑
c(HCl)== 1.0mol/L(2分)
原样品中n(NaHCO3)= n(HCl)= 1.0mol/L×110 mL/1000 mL/L=0.11 mol
原样品中NaHCO3的质量:0.11 mol×84 g/mol=9.24 g (1分)
(3)依据题意,样品A中含有NaHCO3和Na2CO3·nH2O
设样品A中NaHCO3和Na2CO3·nH2O 的物质的量分别为a和b
则a+b=2240 ml/22400 mL/mol
a+2b=0.11 mol
a=0.090mol b=0.010mol
n(H2O)=(9.16 g-0.090mol ×84 g/mol-0.010mol×106 g/mol)/18 g/mol
=0.03 mol (2分)
Na2CO3·nH2O为Na2CO3·3H2O,物质的量为为0.010mol
NaHCO3为0.090mol (2分)
答:样品A中含有0.090mol NaHCO3,0.010mol Na2CO3·3H2O。
10. 下列实验操作中,错误的是
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加适量的水搅拌溶解
B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次
D.配制0.1 mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
9. 物质的量为a mol的CaCl2溶解在1 mol H2O中,测得溶液中Cl-与水分子的物质的量之比为1∶10,则a为
A.0.05 mol B.0.1 mol C.0.5 mol D.10 mol
8. t℃时,将w g化合物A放入水中充分溶解,制得Y g饱和溶液,化合物A的相对分子质量为M,饱和溶液密度为d g·cm-3,其质量分数a%,t℃时,A的饱和溶液的物质的量浓度为
A.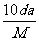 mol/L B.
mol/L B.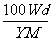 mol/L C.
mol/L C.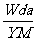 mol/L D.
mol/L D. mol/L
mol/L
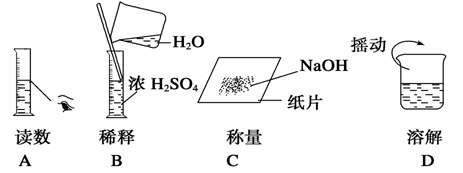
7. 下图分别表示四种操作,其中有两处错误的是
6. 两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为
两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为
A. B.
B. 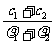 C.
C. 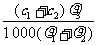 D.
D. 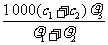
5. 设NA为阿伏加德罗常数的值,下列关于0.2 mol/L的Ba(NO3)2溶液说法不正确的是
A.2 L溶液中的阴、阳离子总数为0.8NA
B.500 mL溶液中NO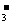 浓度为0.2 mol/L
浓度为0.2 mol/L
C.500 mL溶液中Ba2+浓度为0.2 mol/L D.500 mL溶液中NO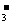 总数为0.2NA
总数为0.2NA
4.氯酸钾跟浓盐酸反应生成氯气,化学方程式为:KClO3+6HCl KCl+3Cl2↑+3H2O,若反应使用的是K37ClO3和H35Cl,则所得氯气的摩尔质量/ g·mol-1约为
A.70.7 B.71.0 C.72.0 D.73.3
3.下列事实中不能说明氯的单质分子是双原子分子的是
A.在标准状况下,氯单质为气态
B.在标准状况下,71g的氯气所占的体积约为22.4L
C.2.24L(标准状况)Cl2与金属反应时最多可得到0.2mole-
D.0.2mol单质钠恰好与2.24L(标准状况下)氯气反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com