
1. B;2.C。
讲析:1.酚羟基有两个邻位可取代,需2molBr2,一
个碳碳双键加成需1molBr2,一共3 molBr2。右边的六元环具有酯的结构,水解后生成-COOH和-OH,但-OH连在苯环上,是酚类,而不是醇!共有三个酚-OH和一个-COOH,需NaOH为4mol。2.由于是对苯二酚的阴离子对已暴光的AgBr有显影作用,故使显影速度明显加快则必须使第一个反应向正向移动,应加入能与H+反应的物质,只有Na2CO3,其余都不行。
13.


讲析:M=108g/mol,n(有机物)=0.1mol,
n(CO2)=0.7mol,n(H2O)=0.4mol,得出一分子有机物中含7个C,8个H,由分子量再进一步算出有1个O,分子式为C7H8O,该有机物能跟NaOH溶液反应,它是酚类,除了苯环、羟基,还有一个甲基,甲基和羟基在苯环上的相对位置有邻、间、对三种。
第39课时 (B卷
纠错训练
11.14; C14H20O;

讲析:比较A、B可知每个短线折点处表示有一个碳原子,一根短线表示一价,缺少的氢原子数目可根据碳必须满足四价得到,故分子式为C14H20O。因D中有酚的结构,即一定有苯环和直接连接在它上的羟基,再根据C14H20O的不饱和度为5,减去苯环的不饱和度4,还剩1,余基上必有一个双键或一个环,再由D中没有甲基,得到D 的结构简式。
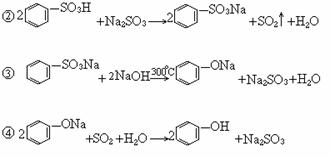 12.(1)
12.(1)
(2)根据较强酸可从弱酸盐中制取弱酸的原理,由反应②、④可知酸性强弱顺序是:苯磺酸>亚硫酸>苯酚。
讲析:②、④两步根据较强酸可从弱酸盐中制取弱酸的原理就能写出,而第③步的产物已指出。本题根据信息直接作答。
9.同系物首先必须具有相似的结构,应理解为具有相同种类和数目的官能团。B、C、D结构均不相似。
7.A;8.B; 9.A;10.D。
讲析:2.苯酚从溶液中析出时先有沉淀,后逐渐出
现分层现象,且苯酚在下层,用分液漏斗分离。4.本题涉及的物质种类较多,涉及的性质也较多。溴水与C2H5OH互溶,与C6H6不溶且溴转到上层,与C6H5NO2不溶且溴转到下层,与NaOH(aq)反应颜色褪去,与C6H5OH(aq)有白色沉淀,与AgNO3(aq)有淡黄色沉淀。氯化铁溶液与六种物质的作用跟溴水类似。盐酸无法区分NaOH(aq)与NaOH(aq),氯化铝溶液无法区分C2H5OH与C6H5OH(aq)。
1. B;2.D;3.A、D;4.A、D;5.C;6.D;
2.酸性H2CO3> >HCO3-,则碱性CO32-
> > HCO3-,根据较强的酸制较弱的酸,较强的碱制较弱的碱的原理判断,选项A、D是错的。
 3.
3.
③→④

③→⑥

⑧→⑦
(注:方程式中的NaHSO3写成Na2SO3也对)

讲析:根据化合物⑤,可知④物质应是
 因为④→⑤的反应是-NO2被还原成-NH2,而另一侧链没有变化。③→④的反应式是信息的逆向思维,③→④的另一反应物是CH3OH。③→⑥反应直接利用信息,③→
因为④→⑤的反应是-NO2被还原成-NH2,而另一侧链没有变化。③→④的反应式是信息的逆向思维,③→④的另一反应物是CH3OH。③→⑥反应直接利用信息,③→
⑧的反应式为
⑧→⑦的反应类似于苯酚钠与碳酸的反应。
新活题网站
1. D;2.B、C
讲析1.1mol白藜芦醇中,碳碳双键与溴水加成需
1molBr2,左边苯环有一个羟基,它有两个邻位可取代,需2molBr2,右边苯环有两个羟基,它有三个邻位可取代,需3molBr2,这样共需6molBr2。与H2发生加成,一个苯环需3mol H2,碳碳双键需1mo H2,这样共需7mol H2。

2.[江苏省射阳中学2009届高三第二次月] (14分)
(1)右图折线c可以表达出某一主族元素氢化物的沸点的变化规律,C线上任一物质其VSEPR模型和分子空间构型 。(填“相同”或“不同”)两位同学对某另一主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是: (填“a”或“b”);
(2)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
( )。下列关于三聚氰胺分子的说法中正确的是
。
)。下列关于三聚氰胺分子的说法中正确的是
。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
(3)金属是钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
(4)I.某种钾的氧化物(氧化钾、过氧化钾或超氧化钾中的一种)的晶胞如图所示(每个黑点或白空点都表示一个阴、阳离子)。则该氧化物的化学式为 。
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
如果将1 mol该晶胞完全转化变成相应的气态离子需吸收的能量为b kJ,则该晶体的晶格能为 。
Ⅱ.如果将上图中的白点去掉并将黑球换成相应的分子或原子,可以得到干冰或
铜的晶胞,它们的配位数均为 。
1.[江苏省射阳中学2009届高三第二次月]下列说法中正确的是:①所有基态原子的核外电子排布都遵循构造原理 ②同一周期从左到右,元素的第一电离能、电负性都是越来越大 ③所有的化学键和氢键都具有相同的特征:方向性和饱和性 ④所有的配合物都存在配位键,所有含配位键的化合物都是配合物 ⑤所有含极性键的分子都是极性分子 ⑥所有离子晶体中都含有离子键 ⑦所有的金属晶体熔点肯定高于分子晶体[B]
A.①② B.⑥ C.③④⑤ D.①②⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com