
4.下列每种粒子中,所含化学键完全相同的是
A.Na2O2 B.H2O2 C.H2O D.NH4Cl
3.下列各分子中,化学键类型有差异的是
A.H2O、CO2 B.MgF2、H2O2 C.NaOH、Ba(OH)2 D.NaCl、KCl
2.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是
A.CO2 B.PCl3 C.CCl4 D.NO2
1.下列物质中含有共价键的离子化合物是
A.Ba(OH)2 B.CaCl2 C.H2O D.H2
2.氢键
(1)形成条件:原子半径较小,非金属性很强的原子X(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键
(2)表示方法:X-H…Y-H(X.Y可相同或不同,一般为N、O、F)。
(3)氢键能级:比化学键弱很多但比分子间作用力稍强
(4)氢键特征:具有方向性。

雪花晶型


(5)氢键作用:使物质有较高的熔、沸点(H2O、HF、NH3) 使物质易溶于水(C2H5OH,CH3COOH) 解释一些反常现象。
结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
[思考] 为什么冰会浮在水面上? 雪花为什么是六角形的?
[讨论] 如果水分子之间没有氢键存在,地球上 将会是什么面貌?
[课堂练习]
1.分子间作用力
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
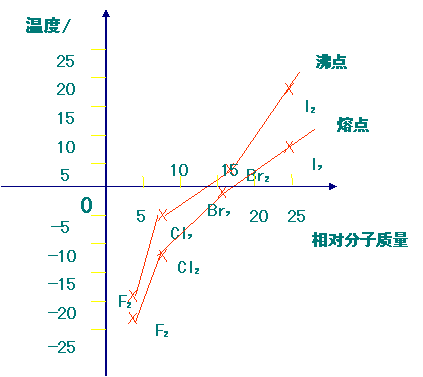
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
卤素单质的熔、沸点与相对分子质量的关系:
随着相对分子质量的增大,分子间作用力增大(即范德华力增大),熔沸点逐渐升高。(如下图)

应 用
对于四氟化碳、四氯化碳、四溴化碳、四碘化碳,其熔沸点如何变化?


[归纳] 分子间作用力与化学键的比较
|
|
作用微粒 |
作用力大小 |
意 义 |
|
化学键 |
原子 |
作用力大 |
影响化学性质和物理性质 |
|
范德华力 |
分子 |
作用力小 |
影响物理性质(熔、沸点等) |
[讨论] 为什么HF、H2O和NH3的沸点会反常呢?
2、用化学键的观点来分析化学反应的本质是什么?
[小结] 化学反应的实质:旧化学键断裂和新化学键形成的过程.
第一步:反应物分子中化学键断裂成原子;
第二步:原子间通过新的化学键重新组合成新的分子.
[练习] 解说H2和N2生成NH3的过程。
注意:
离子化合物受热熔化时会破坏离子键,从水溶液中结晶形成离子化合物时会形成离子键;但这两个过程均属于物理变化.所以破坏化学键不一定发生化学变化,但化学变化过程中一定有化学键的断裂和新化学键的形成.
化学键的存在:
稀有气体单质中不存在;
多原子单质分子中存在共价键;
非金属化合物分子中存在共价键(包括酸);
离子化合物中一定存在离子键,可能有共价键的存在(Na2O2、NaOH、NH4Cl),共价化合物中不存在离子键;离子化合物可由非金属构成,如:NH4NO3、NH4Cl 。
化学键之回顾练习
书写下列物质的电子式,分析其中的化学键的类型:
A、HCl 极性共价键
B、N2 非极性共价键
C、NaCl 离子键
D、NaOH 离子键、极性共价键
E、Na2O2 非极性共价、离子键
F、NH4Cl 配位键、极性共价和离子键
[科学视野] 四、分子间作用力和氢键
1、用电子式表示下列化合物的形成过程(分组练习)
NaCl Na2O HF NaH NH4Cl CO2 Br2 O2 Na2O2 N2 H2O NaOH
4.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是(D)
A.CO2 B.PCl3 C.CCl4 D.NO2
[教学后记]
必修2 第一章 物质结构 元素周期律
第三节 化学键
第3课时
[教学目标] 了解分子间作用力的本质
了解氢键及其氢键对物质熔沸点的影响
[教学重点] 分子间作用力
[教学难点] 氢键的特点及其方向性
[教学过程]
[复习]
3.下列物质的电子式书写正确的是(C)
A.Na2O  B.H2S
B.H2S 

C.H2O2  D.N2 N∶∶∶N
D.N2 N∶∶∶N
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com