
29.(10分)(1) ; ____________。
(2) 。
(3) ;
(4) 。
28.(15分)(1) 锌极 铜极
(2) a极:
b极: 反应(氧化或还原)
27. (10分)(1) (2)
(3) (4)
(5)
26. (3分)
25. (6分)(1)
(2)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
|
|
|
|
|
|
|
|
|
|
|
|
31.有一硝酸盐晶体,分子式为M(NO3)x·nH2O,经测定其摩尔质量为242 g / mol。取1.21 g此晶体溶于水,配制成100 mL溶液。 将其置于电解池中用惰性材料为电极进行电解。经测定,当有0.01 mol电子通过电极时,溶液中全部金属离子即在阴极上析出,电极增重0.32 g。
(1) 1.21 g此盐晶体的物质的量是多少?x值是多少?
(2) 求M的相对原子质量和n值.
三明一中2010-2011学年度上学期第一次月考试卷
高二化学答题卷 座位号___________
30.在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后测得
c(H2)=0.008mol/L。求:
(1)该反应的平衡常数。
(2)在同样的温度下,该容器中若通入H2和I2(g)各0.20mol,试求达到平衡状态时H2的转化率
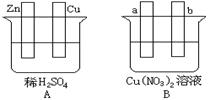
28.(15分)按要求对下图中两极进行必要的连接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫 。电极反应式:锌极: ;铜极: 。
(2)在B图中(a,b都为惰性电极),使a极析出铜,则b析出: 。加以必要的连接后,该装置叫 。电极反应式,a极: b极发生 反应(氧化或还原)。经过一段时间后,停止反应并搅均溶液,溶液的[H+] (升高、降低、不变),加入一定量的 , 溶液能 恢复至与电解前完全一致。
恢复至与电解前完全一致。
|
|
|
两管中产生气体的质量之比(Ⅰ:Ⅱ)是 。
(2)断开S1接通S2,C(Ⅱ)的电极反应式是
(3)将溶液改为硫酸铜溶液,接通S1,断开S2,写出电解反应的化学方程式 。
(4)利用该装置对粗铜进行电解精炼,则电极材料C(Ⅰ)应改为
27. (10分)用50 mL 0.50mol·L-1盐酸与50 mL 0.55
mol·L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热。
(10分)用50 mL 0.50mol·L-1盐酸与50 mL 0.55
mol·L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度t2/℃ |
温度差 (t2-t1)/℃ |
||
 |
 |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.2 |
24.45 |
27.6 |
3.15 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪器是 ;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是 ;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指 温度;
(4)计算该实验发生中和反应时放出的热量为 kJ(保留两位小数)[中和后生成的溶液的比热容c=4.18 J·(g·℃)-1,稀溶液的密度都为1 g·cm-3];
(5)如果用50 mL 0.55 mol·L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其放出的能量将偏小,其原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com