
19、 (15分) 碱式碳酸铜可表示为:xCuCO3·yCu(OH)
2·zH2O,测定碱式碳酸铜组成的方法有多种。
(15分) 碱式碳酸铜可表示为:xCuCO3·yCu(OH)
2·zH2O,测定碱式碳酸铜组成的方法有多种。
 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题:
 ①写出xCuCO3·yCu(OH)
2·zH2O与氢气反应的化学方程式
;
①写出xCuCO3·yCu(OH)
2·zH2O与氢气反应的化学方程式
;
 ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):

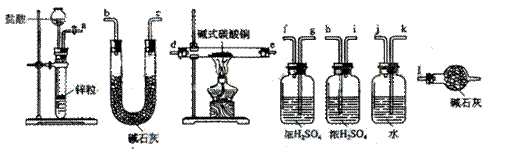 (a)→( )( )→( )(
)→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )(
)→( )( )→( )( )→( )( )→(l)







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
 (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。

























18、 (13分)A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:
(13分)A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:




















 ⑴ A、B的元素符号分别为
、 。
⑴ A、B的元素符号分别为
、 。
 ⑵ 写出Y水解的离子方程式 。
⑵ 写出Y水解的离子方程式 。
 ⑶ 将9g B单质在空气中充分燃烧,所得气体通入l L l mol/L NaOH溶液中,完全吸收后,溶液中各离子浓度由大到小的顺序是
。
⑶ 将9g B单质在空气中充分燃烧,所得气体通入l L l mol/L NaOH溶液中,完全吸收后,溶液中各离子浓度由大到小的顺序是
。
 ⑷ 在101kPa时,1g X气体在D单质中充分燃烧,生成一种液态化合物和另一种对环境无污染的稳定物质,放出18.6 kJ的热量。该反应的热化学方程式为:
⑷ 在101kPa时,1g X气体在D单质中充分燃烧,生成一种液态化合物和另一种对环境无污染的稳定物质,放出18.6 kJ的热量。该反应的热化学方程式为:
 ________ ____
________ ____
17、 (15分)A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
(15分)A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ Fe3+ |
|
阴离子 |
OH- Cl-   HCO3- HCO3- |
分别取它们的水溶液进行实验,结果如下:
 ①A溶液分别其他四种溶液反应,均有沉淀;
①A溶液分别其他四种溶液反应,均有沉淀;
 ②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
 据此推断它们是A
;B ;C
;D
;E
。
据此推断它们是A
;B ;C
;D
;E
。
16. (12分)已知氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,NaBiO3溶液为无色。取一定量的酸性Mn(NO3)2溶液依次进行下列实验,现象记录如下。
(12分)已知氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,NaBiO3溶液为无色。取一定量的酸性Mn(NO3)2溶液依次进行下列实验,现象记录如下。




















 ①滴加适量的NaBiO3溶液,溶液变为紫红色。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
 ②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
 ③再加适量的PbO2固体,固体溶解,溶液又变为紫红色。
③再加适量的PbO2固体,固体溶解,溶液又变为紫红色。
 ④最后通入足量的SO2气体,请回答下列问题:
④最后通入足量的SO2气体,请回答下列问题:
 (1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为
;
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为
;
 (2)实验④中的现象为
;
(2)实验④中的现象为
;
 (3)实验②的离子方程式是: .
(3)实验②的离子方程式是: .
 实验③的离子方程式是 。
实验③的离子方程式是 。
15、 为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[
为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[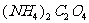 ]处理成草酸钙沉淀,将此沉淀溶于过量的稀
]处理成草酸钙沉淀,将此沉淀溶于过量的稀 中,然后用
中,然后用 溶液(生成
溶液(生成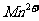 、
、 、
、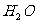 )恰好消耗1.6mL,则该病人血液中含钙量为
)恰好消耗1.6mL,则该病人血液中含钙量为
 A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
第Ⅱ卷(非选择题 共55分)
14、 高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:
高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:
 Fe(OH)3+ClO-+OH- 一FeO4 2-+Cl- +H2O(未配平),在上述反应中( )
Fe(OH)3+ClO-+OH- 一FeO4 2-+Cl- +H2O(未配平),在上述反应中( )
 A.FeO4 2-是还原产物
B.ClO-是还原剂
A.FeO4 2-是还原产物
B.ClO-是还原剂
 C.1molFe(OH)3得到3mol电子 D.配平后OH- 的化学计量数为4
C.1molFe(OH)3得到3mol电子 D.配平后OH- 的化学计量数为4
13. 能正确表示下列反应的例子方程式是
能正确表示下列反应的例子方程式是
 A. 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO
A. 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO
 B. 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
B. 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
 C. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
 D. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
12. xR2++yH++O2
xR2++yH++O2 mR3++nH2O中,对m和R2+、R3+判断正确的是
 A、m=4,R2+是氧化剂 B、2m=y,R3+是氧化剂
A、m=4,R2+是氧化剂 B、2m=y,R3+是氧化剂
 C、m=4,R2+是还原剂 D、m=
C、m=4,R2+是还原剂 D、m= ,R3+是还原剂
,R3+是还原剂
11. 将下列各组中两种金属的混合物3g投入水中,收集到标准状况下H2
1.12L。不可能构成此种混合物的是
将下列各组中两种金属的混合物3g投入水中,收集到标准状况下H2
1.12L。不可能构成此种混合物的是
 A、Rb和Na B、Rb和K C、Na和Cu D、K和Na
A、Rb和Na B、Rb和K C、Na和Cu D、K和Na
10. 在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同且甲的密度大于乙的密度,则下列说法正确的是
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同且甲的密度大于乙的密度,则下列说法正确的是
 A.甲的分子数比乙的分子数多
A.甲的分子数比乙的分子数多
 B.甲的物质的量比乙的物质的量少
B.甲的物质的量比乙的物质的量少
 C.甲的摩尔体积比乙的摩尔体积小
C.甲的摩尔体积比乙的摩尔体积小
 D.甲的相对分子质量比乙的相对分子质量小
D.甲的相对分子质量比乙的相对分子质量小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com