
2.有拒绝平庸气度。拒绝平庸就要突破模式的束缚。模式是出奇的死敌,只有突破模式的桎梏,不顺从既定的思路,采取灵活多变的思维战术,多方位、跳跃式地从一个思维基点跳到另一个思维基点,才能写出与众不同的东西,才能让创新的思想在蓝天上自由飞翔。而没有独特的个性特征,则容易流于平淡、落人俗套。
1.有敢冒风险勇气。出奇是一种可贵的创新思维,更是一种可贵的精神境界,没有一点冒险精神,满足于四平八稳,如何能摧枯拉朽,推陈出新?凡有创新品质的考生,即使在大的立意观点方面一时无法全面突破,也应尽量在细小的方面“跳一跳”。
5.离子半径的比较。同族元素相同价态的离子随核外电子层数的增多离子半径增大(F-<Cl-<Br-<I-,Na+<K+<Rb+<Cs+)。核外电了层结构相同的离子随核电荷数的增加,离子半径减小(O2->F->Na+>Mg2+>Al3+)。
例1、A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02gH2,用0.4gA。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
①写出两种元素的名称A__________,B___________
②用结构示意图表示A、B两元素的常见离子。A__________、B________
解析:红棕色液体为溴单质,则B为溴元素。由An+ + ne = A,可知n=2 ,A的化合价为+2价。

 A=40
A=40
答案:①A 钙 B 溴 ②Ca2+ Br-
例2、A、B二种短周期的元素可以形成两种不同的共价化合物C与D。A在化合物C中显-1价,在化合物D中显-2价。化合物C在一定条件下反应产生A的单质。化合物D较为稳定。元素A位于周期表第_______周期,______族;化合物C的电子式______,化合物D的化学式____________。
解析:短周期元素中,显-2价为第ⅥA的元素,只能是氧和硫。在中学化学知识中硫通常无-1价。而氧在过氧化物中显-1价,因此A为氧元素。但C、D均为共价化合物,故C为H2O2,B元素为氢。
 答案:第二周期,第ⅥA族,H O O H、H2O
答案:第二周期,第ⅥA族,H O O H、H2O
例3、现有原子序数之和为51的五种短周元素A、B、C、D、E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
①试写出它们的元素符号。
②写出B的氢化物的电子式。
③B的气态氢化物与D的气态氢化物互相作用生成的物质,其电子式为_________或___________.
解析:B原子的次外层只能为K层,所以B为氮,C为磷,最高正价和负价的代数和为4时,只有最高正价为+6价,负价为-2价,即ⅥA元素符合,因其含氧酸性为本周期元素的含氧酸中之最强,所以D元素为硫,E为镁,再由原子序数之和为51,而B、C、D、E原子序数均已知,肯定A为氢。
 答案:① H、N、P、S、Mg ② H N H
答案:① H、N、P、S、Mg ② H N H
③ [H N H ]+[ S ]2-[H N H]+ 或 [H N H]+[H S ]-
4.非金属元素的原子间可形成离子化合物。如:NH4Cl、NH4NO3、NH4HCO3等。
3.单质分子中的化学键均为非极性键,化合物分子中可有非极键,离子化合物中
 可存在极性键和非极性键。如N?N(N? N叁键为非极键)H-O-O-H(H-O键为极性键,O-O键为非极性键),Na+[ O O]2-Na (O-O键为非极性键,Na+与O2-间为离子键)
可存在极性键和非极性键。如N?N(N? N叁键为非极键)H-O-O-H(H-O键为极性键,O-O键为非极性键),Na+[ O O]2-Na (O-O键为非极性键,Na+与O2-间为离子键)
2.共价化合物中只有共价键,离子化合物中一定含有离子键。如H2O(共价化合物)

 H O O H (由共价键形成),NaOH(离子化合物),Na+[
O H]-(由共价键和离子键形成)。
H O O H (由共价键形成),NaOH(离子化合物),Na+[
O H]-(由共价键和离子键形成)。
1.共价键可存在于单质分子、共价化合物分子和离子化合物中。
 分子
分子



 N2: N N (N=N) Cl2: Cl Cl (Cl-Cl) H2O: H O (H-O)
N2: N N (N=N) Cl2: Cl Cl (Cl-Cl) H2O: H O (H-O)
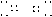 CO2: O C O (O=C=O) CH4: H C H (H-C-H)
CO2: O C O (O=C=O) CH4: H C H (H-C-H)
|
项 目 |
概 念 |
对分子的影响 |
|
键 能 |
拆开1摩共价键所吸收的能量或生成1摩共价键所放出的能量 |
键能大、键牢固、分子稳定 |
|
键 长 |
成键的两个原子的核间的平均距离 |
键越短、键能越大,键越牢固,分子越稳定 |
|
键 角 |
分子中相邻键之间的夹角 |
决定分子空间构型和分子的极性 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com