
20. (各空2分,共12分) 答案:(1)NaN3,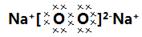 (2)2Na2O2+4CO2+2H2O=4NaHCO3+O2
(2)2Na2O2+4CO2+2H2O=4NaHCO3+O2
(3)6Na+2Fe2O3=3Na2O2+4Fe ,红色粉末的作用是充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质),提供大量的热量用于氮化钠的迅速分解。(4)从氧化性角度分析KNO3、CuO均可,但KNO3本身受热分解,产生氧气与氮气反应。故选择D. CuO。
19. 答案(1)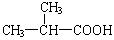 (2分) (CH3)2C=CH2 (2分) (2)
(2分) (CH3)2C=CH2 (2分) (2)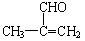 (2分)
(2分)
(3) (2分)
(2分)
 (2分)
(2分)
(4)水解反应(1分) 取代反应(1分) 氧化反应(1分) (5)CH3CH=CHCOOH、 CH2=CHCH2COOH。(3分)
18、(12分)(1)b; (1分)(2)取C中少量溶液加入足量的稀盐酸,再加入少量BaCl2溶液,若产生白色沉淀,则Na2SO3 已有被氧化。(2分)
(3)HCO3- + Cl2 = CO2↑ + Cl- + HClO。(2分)(分步方程也一并给分)
(4)Cl2有毒,缺少氯气的尾气吸收装置(氢氧化钠溶液)。(2分)
(5) 2H++ ClO- + 2I- === H2O+ Cl- + I2 (2分) 35. 75%(3分)
17.(6分)
⑴A:BaCl2 (1分) C:CuSO4(1分)
⑵CO +2H+===
H2O+CO2↑(2分)
+2H+===
H2O+CO2↑(2分)
⑶Cu2++SO +Ba2++2OH-===BaSO4↓+Cu(OH)2↓(2分)
+Ba2++2OH-===BaSO4↓+Cu(OH)2↓(2分)
|
1D |
2C |
3B |
4A |
5B |
6B |
7C |
8D |
|
9D |
10C |
11B |
12D |
13B |
14D |
15B |
16B |
21.(6分)计算题:
向一定量的Fe.FeO.Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标况下)的气体。所得溶液中加入KSCN溶液无血红色出现,问(1)混合物中含铁元素的质量为多少克?(2)混合物中铁元素所占质量分数为多少?
20. (12分)汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A. KCl B. KNO3 C. Na2S D. CuO
19. (16分)A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
(1)B分子内有3种等效氢,则B的结构简式为 ;
C分子结构中具有支链,在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为 。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为
(3)写出⑤的化学反应方程式 。
⑨的化学反应方程式 。
(4)①的反应类型 ,④的反应类型 ,⑦的反应类型 。
(5)与H具有相同官能团的H的同分异构体的结构简式为 ________ 。
18. (12分)某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4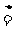 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。

试回答:
(1)该实验中A部分的装置是 (填写装置的序号)。

(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式 。
(4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g ,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。写出发生反应的离子方程式 。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:
17. .(6分)A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO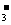 、SO
、SO 、Cl-、CO
、Cl-、CO 的中的一种。
的中的一种。
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断它们的化学式为:
⑴A ,C
⑵写出足量盐酸与D反应的离子反应方程式:
⑶写出C与Ba(OH)2溶液反应的离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com