
5、关于16世纪的宗教改革,有人曾这样比喻:“教会原本是教徒与上帝的接线员,于是借助这个电信垄断地位大发横财。自此之后,人人自带直拨上帝的‘热线’了。”从材料中能够反映出的主要观点是( )
A.主张废除教阶制度与宗教仪式 B.否定信仰上帝
C.宣扬《圣经》至高无上 D.挑战教皇权威
4、《蒙娜丽莎》典型地表现了文艺复兴时期的时代精神和人格力量,是一部伟大的人文主义作品,因为( )
A、达.芬奇成功的运用“圣像图”的画法 
B、它是文艺复兴时期的代表作品 C、达.芬奇将解剖学、透视法和明暗转移法运用其中 D、它肯定人的价值,颂扬人的力量,表现人性的美
3、战国时期的百家争鸣与欧洲文艺复兴运动的相似之处是( )
A.都处于封建社会初步形成的铁器时代 B.矛头都指向奴隶制残余
C.都在政治制度、思想文化方面提出了新内容 D.都在思想领域中重视人的作用
2、“对哲学家来说,死是最后的自我实现。是求之不得的事,因为它打开了通向真正知识的门。灵魂从肉体的羁绊中解脱出来,终于实现了光明的天国的视觉境界。”( )
A、泰勒斯  B、普罗塔哥拉
C、苏格拉底 D、亚里士多德
B、普罗塔哥拉
C、苏格拉底 D、亚里士多德
1、 当时儒家“民本思想”与智者学派的“人文主义”思想出现的社会背景,主要不同( )
当时儒家“民本思想”与智者学派的“人文主义”思想出现的社会背景,主要不同( )
A.讨论主题不同 B.诞生的政治氛围不同 C.价值取向不同 D.所处的历史阶段不同
21.(11分)、A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。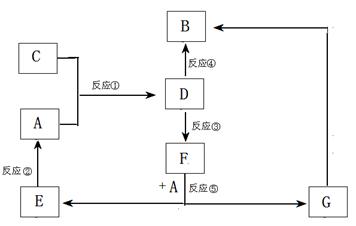 已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液
反应生成不溶于稀硝酸的白色沉淀。(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是 (填序号)。
(2)G生成B有多种途径。若在G的溶液中加入与G等物质的量的Na2O2,恰好使G转化为B,写出该反应的离子方程式:
反应③(即D将某种氧化物氧化为F)的离子方程式
(3)D的水溶液显酸性,请用离子方程式解释原因
(4)将C气体通入淀粉KI溶液。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请写出离子方程式(已知HIO3为弱酸)

20.(11分)氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是 (填字母);

②丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
③该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
18.(12分)I.某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO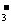 、NO
、NO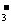 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
(1)该溶液与Al2O3反应后有Al3+生成,一定不会含有大量的 。
(2)该溶液与Al2O3反应后有AlO 生成,可能含有大量的
。
生成,可能含有大量的
。
Ⅱ.研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题;
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
(1)解决问题①需要用到的药品有CuSO4溶液、 (填字母)。
A.AlCl3溶液 B.NaOH溶液 C.稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是
。
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至800℃-1000℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,X的化学式为 ,可以得出的结论是
。
19(8分).某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成
产物并进行实验论证,请你参与以下研究过程。该同学按实验要求,用下列装置进行实验
(已知PdCl2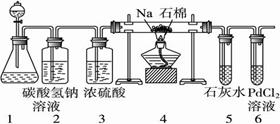 溶液能被CO还原得到黑色的Pd),请完成下列问题:
溶液能被CO还原得到黑色的Pd),请完成下列问题:
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
③指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳: 。
17.(10分)常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是: 。
(2)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法: 。
(3)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合化学方程式说明) : 。
(4)某同学利用上述滤液制取白色的Fe(OH)2、沉淀,向滤液中加入NaOH溶液后,观察至生成的白色的沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→红褐色的化学方程式是: 。
16.将1 mol 含镁物质的量分数为a的镁铝合金溶于含有b mol HNO3的稀溶液中,刚好完全反应,NO为唯一还原产物。向所得溶液中逐滴加入NaOH溶液至沉淀不再减少为止,将所得沉淀过滤、洗净、灼烧至恒重,所得固体质量与原合金质量相等。下列说法中正确的是
①合金含镁质量分数为60%;②反应中放出气体体积在标准状况下为(1-a/3)× 22.4 L;③反应过程中最大沉淀质量为(78-20a)g;④反应中共消耗NaOH[b-(1-a/3)]mol
A.①②③ B.①②④ C.①③④ D.②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com