
1.物理性质:Al(OH)3是几乎不溶于水的 ,具有 性。
0.1mol 0.1mol 0.05mol 0.1mol 0.15mol
若铝箔足量,共生成H2:0.05mol+0.15mol=0.2mol
V(H2)=0.2mol×22.4mol/L=4.48L。
[答案]C
[规律总结]铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
考点2 氢氧化铝
5.与碱反应
镁不与碱反应,铝与碱液反应: 。
[例1]用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况) ( )
A.O2和H2的混合气体 B.1.12L H2 C.大于1.12LH2 D.小于1.12L H2
[解析]Na与水反应放出H2,并且生成NaOH,铝能与NaOH溶液反应,也生成H2,故最后收集到的气体是这两部分H2总和,显然比Na单独反应产生的H2多。
2Na+2H2O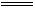 2NaOH
+H2↑
2A1+6H2O
2NaOH
+H2↑
2A1+6H2O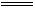 2A1(OH)3+3H2↑
2A1(OH)3+3H2↑
4.与某些氧化物反应
(1)镁与二氧化碳反应:2Mg+CO2
|
[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。 |
(2)铝热反应:2Al+ Fe2O3
铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
|
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3 、FeO、Fe3O4、Cr2O3、V2O5、MnO2等。 ②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。 ③要使用没有氧化的铝粉,氧化铁粉末要烘干。 ④KClO3作为引燃剂,也可以用Na2O2代替。实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。 |
3.与酸反应置换出H2
Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。所以 用铝制容器贮存冷的浓硫酸或浓硝酸。
2.与H2O反应
Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气
Mg+2H2O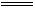 2A1+6H2O
2A1+6H2O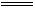
1.与非金属反应
(1)与O2反应。常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。镁、铝都能在空气中燃烧: 。
(2)与卤素单质、硫等反应。Mg+ Cl2 2Al+ 3Cl2
2Al+ 3Cl2
2Al+ 3S (用于工业制备) Mg+ S
(用于工业制备) Mg+ S
|
[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。镁在空气中燃烧时有三个反应发生: 2Mg+O2  2MgO 3Mg+N2 2MgO 3Mg+N2 Mg3N2 2Mg+CO2 Mg3N2 2Mg+CO2 2MgO+C 2MgO+C②燃烧时都放出大量的热,发出耀眼的白光。利用镁的这种性质来制造照明弹。 ③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。 |
2.碱金属的性质规律与特例
(1)通常合金多呈固态,而钠钾合金却是液态。
(2)碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
(3)碱金属单质密度一般随核电荷数增大而递增,但K的密度比Na小。
(4)碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。
(5)碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
(6)碱金属的盐一般都易溶于水,但Li2CO3却微溶。
(7)一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
(8)试剂瓶中的药品取出后,一般不能放回原瓶,但IA金属Na、K等除外。
(9)一般活泼金属能从盐中置换出不活泼金属,但对IA非常活泼的金属Na、K等除外。如:2Na+CuSO4+2H2O Cu(OH)2↓+H2↑+Na2SO4。
Cu(OH)2↓+H2↑+Na2SO4。
(10)Fr是放射性元素,所以在自然界中不存在。
[例4] 下列有碱金属铷(Rb)的叙述中,正确的是 ( )
A.灼烧氯化铷时,火焰有特殊颜色 B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是弱碱
[解析]与钠元素相似,铷元素也有焰色反应,选项A正确;与NaNO3相似,RbNO3是离子化合物,易溶于水,选项B正确;碱金属从锂到铯,熔点逐渐降低,选项C错误;碱金属的氢氧化物均为强碱,选项D错误。
[答案]AB。
[备考反思]由所学物质的结构、性质来推断结构相似、未学物质的性质,是中学化学重要的一类习题。解答此类题目的关键就是要考虑二者的相似性和递变性。对碱金属元素单质及其化合物的性质的相似性和递变性及特殊性一定要熟悉。
1.焰色反应
(1)概念: 在燃烧时使火焰呈特殊的颜色,叫焰色反应。
(2)用品: (或铁、铬、镍、钨等)、 (或煤气灯)、试剂。
(3)焰色反应鉴别盐类的步骤:①铂丝在火焰上灼烧至原火焰色。②蘸取溶液(沾取固体)放在火焰上灼烧,观察火焰颜色,观察钾火焰颜色要 去观察。③盐酸洗铂丝。④铂丝在火焰上灼烧至原火焰色(如不能灼烧至原火焰色,则需再酸洗,再灼烧)。⑤再蘸取(沾取)另外化学药品进行实验。
钾、钠焰色反应颜色:钾--紫色(透过蓝色钴玻璃);钠--黄色。
2.碳酸氢钠和碳酸钠的制法
(1)制取NaHCO 3的方法
①减压低温蒸干NaHCO3溶液。NaHCO3遇热易分解,其水溶液加热更易分解,所以不可能采用常压下蒸发溶剂的方法制得NaHCO3晶体。
②往饱和Na2CO3 溶液中通入CO2,过滤得到晶体。Na2CO 3+CO 2+H2O 2NaHCO
3
2NaHCO
3
(2)联碱法制纯碱原理
①在饱和食盐水中通 饱和后,再通 :NH3+CO2+H2O NH4HCO3
NH4HCO3
②生成NH4HCO3的溶解度大,而c(Na+)也大,而NaHCO3溶解度小,故产生沉淀:NaCl+ NH4HCO3 NaHCO3↓+NH4Cl,总方程式:
。
NaHCO3↓+NH4Cl,总方程式:
。
③将析出沉淀加热,制得Na2CO3(纯碱)
|
[特别提醒]:不能先通入CO2达饱和后再通入NH3,因为CO2在水中的溶解度很小(1∶1),即使通入过量的NH3,所生成的NaHCO3、NH4Cl也很少,这样就无法制取NaHCO3。 |
[例3] 下列实验能成功的是 ( )
①用水鉴别Na2CO3和NaHCO3固体;②用观察法区别Na2O和Na2O2;③用MgCl2溶液鉴别Na2CO3溶液和NaOH溶液;④用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液。
A.①②③④ B.①② C.②③ D.①②④
[解析]Na2CO3溶解度远大于NaHCO3,取等量水,溶解得多的固体就是Na2CO3。Na2CO3还能与水结合成块状Na2CO3·10H2O,分别取a g固体,各加b mL的水,搅拌,有溶液的为NaHCO3,只形成块状固体的为Na2CO3。Na2O呈白色,Na2O2为黄色,观察即可分辨。MgCO3与Mg(OH)2都难溶于水,故MgCl2溶液不能区别Na2CO3溶液和NaOH溶液。Na2CO3溶液与稀盐酸反应的现象随操作不同而不同,Na2CO3溶液滴入稀盐酸中,立即产生气泡;而将稀盐酸滴入Na2CO3溶液中,先发生反应CO32-+H+ HCO3-,没有立即产生气泡,当CO32-完全转化成HCO3-后再滴盐酸,即相当于在NaHCO3溶液中加稀盐酸,立即产生气泡,所以向未知液中逐滴加稀盐酸的方法可区别Na2CO3溶液和NaHCO3溶液。
HCO3-,没有立即产生气泡,当CO32-完全转化成HCO3-后再滴盐酸,即相当于在NaHCO3溶液中加稀盐酸,立即产生气泡,所以向未知液中逐滴加稀盐酸的方法可区别Na2CO3溶液和NaHCO3溶液。
[答案]D
[黑色陷阱]本题不仅要考虑物质的性质差异,而且要考虑操作方法的不同对差异性质的影响。Na2CO3、NaHCO3溶液滴入到盐酸中的现象是一致的,而稀盐酸滴入这两种溶液中产生气泡是后者快。因忽略了NaHCO3比Na2CO3与酸反应激烈而误选B。
考点4 碱金属
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com