
20.(10分) FeCl3可用作印刷电路铜板腐蚀剂。为回收废腐蚀液中的铜,必须对废腐蚀液的组成进行分析。某同学取废腐蚀液200mL,分成甲、乙两等份。向甲溶液中滴加AgNO3溶液至不再有沉淀产生,得到沉淀129.15g;向乙溶液中加入10g足量铁粉,充分反应,剩余固体质量4.8g。计算中忽略溶液体积的变化。
⑴写出FeCl3溶液腐蚀印刷电路铜板的离子方程式,并标出电子转移的方向和数目 。
⑵废腐蚀液中含有的Cl-离子的物质的量浓度是 。
⑶计算废腐蚀液中铜离子的物质的量浓度(写出计算过程)。
19. (10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
 ⑴.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
⑴.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min).
②该反应的平衡常数表达式为__________________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵.在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为________________________________.
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由______________________________________________.
18.(8分)水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。
己知:C
(s) + H2O(g)  CO (g) +H2 (g);△H
=+131.3kJ•mol-1
CO (g) +H2 (g);△H
=+131.3kJ•mol-1
C (s) + O2(g)=CO (g); △H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l); △H = -285.8kJ·mo1-1
⑴将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中
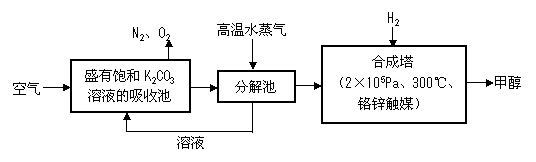 提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶小亮同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小亮应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
17.(12分)由白色和黑色固体组成的混合物A,可以发生如下框所示的一系列变化:


(1)写出反应③的化学方程式: 。
反应④的离子方程式: 。
(2)操作②的名称是 。
(3)下列实验装置中可用于实验室制取气体G的发生装置是 (填序号)。

为了得到纯净干燥的气体G,可将气体通入a和b装置,a、b两广口瓶中所装入的溶液依次是a: ,b: 。c、d装置不完整,请在图中补充完整。

(4)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出d中发生反应的的离子方程式: ;
(5)J是一种极易溶于水的气体,为了防止倒吸,下列e-i装置中,可用于吸收J的
是 。

16.(8分)坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
15.(12分)粗盐提纯的研究。
[有关资料]
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
4.96×10-9 |
4.96×10-9 |
2.34×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
 [设计除杂过程]
[设计除杂过程]
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 。
(2)混合液A的主要成分是 。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
 步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是
(填字母)。A.Na2CO3 B.Na2SO3 C.Na2C2O4
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是
(填字母)。A.Na2CO3 B.Na2SO3 C.Na2C2O4
[获取纯净食盐]
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C,该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
[问题讨论]
(6)在除杂过程中,向粗盐悬浊液中加混合液A,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在 以下。
14. Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是
Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是
 A. 据图计算得n(Mg2+): n(Al3+)=2:1
A. 据图计算得n(Mg2+): n(Al3+)=2:1
B. 小周实验中,OA段生成两种沉淀
C. 图2中OA段表示仅生成Al(OH)3沉淀,AB段仅生成 Mg(OH)2
D. 结合表中数据和图2分析,AB段可能发生:Mg2++2AlO2-+4H2O =2Al(OH)3↓+Mg(OH)2↓
第II卷(非选择题 共72分)
13.下列溶液中微粒的物质的量浓度关系正确的是
A.浓度均为0.1 mol/L的两种溶液:氨水和盐酸,等体积混合后的溶液:
c(H+)= c(OH-) + c(NH3·H2O)
B.向体积为Va 的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+)
C.在NaHB溶液中一定有:c(Na+) + c(H+) =c(HB-) + c(OH-) +2 c(B2-)
D.Na2CO3溶液中:2c(Na+) =c(CO32-) + c(HCO3-) + c(H2CO3)
12.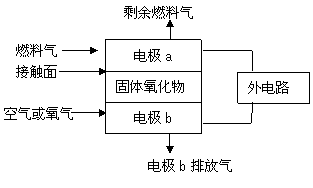 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e-=2O2-
B.固体氧化物的作用是让电子在电池内部通过
C.若H2作燃料气,接触面上发生的反应为:H2+2OH--2e-=2H2O
D.若C2H4作燃料气,接触面上发生的反应为:C2H4+6O2--12e-=2CO2+2H2O
11.下列离子方程式正确的是
A.硫化钠的水解反应:S2-+H3O+ HS-+H2O
HS-+H2O
B.在氯化亚铁溶液中加入稀硝酸:3Fe2+ + 4H+ + NO3-=3Fe3+ + NO↑ + 2H2O

 C.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液: Ca2++HCO3-+OH-=CaCO3↓ + H2O
C.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液: Ca2++HCO3-+OH-=CaCO3↓ + H2O
D.用铜为电极电解稀硫酸溶液: 2H2O O2↑ + 2H2 ↑高考
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com