
7.(浙江省富阳新中2008(上)高三期中考试)硅被誉为无机非金属材料的主角。下列物品用到硅单质的是
A.陶瓷餐具 B.石英钟表 C.计算机芯片 D.光导纤维
答案:C
6.(2009徐州第三次调研卷)化学与能源、信息、材料密切相关。下列说法错误的是
A.石油的催化裂化是为了提高从石油得到的汽油等轻质油的产量和质量
B.开发太阳能、水能、风能等能源,可减少煤、石油等化石燃料的使用
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.氧化铝常用于制造耐火材料,氧化铁常用于制造红色油漆和涂料
答案:A
5. 二氧化硅比二氧化碳熔点高的主要原因是 ( )
A.晶体结构不同 B.二氧化硅分子最大 C.Si-O键的键能大 D.硅原子半径大
答案:A
4. 下列物质久置于空气中(不考虑水分蒸发或吸收空气中的水分)变质,且能析出固体,加入盐酸时固体不溶解的是
A.澄清石灰水 B.硅酸钠溶液 C.氢硫酸 D.氯化钙溶液
答案:B
3. 汉代器物上的颜料“汉紫”至今尚未发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式为BaCuSi2Ox,Cu为+2价),下列有关“汉紫:的说法不正确的是 ( )
A.用盐的形式表示为BaSiO3·CuSiO3 B.用氧化物形式表示为BaO·CuO·SiO2
C.易溶于强酸、强碱 D.性质稳定,不易褪色
答案:A
2. 根据陈述的知识,类推得出的结论正确的是 ( )
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可以使其褪色
C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似
D.金刚石的硬度大,则C60的硬度也大
答案:.B
1.(2008广东)对于下列常见化学的认识错误的是 ( )
A. 明矾可用作净水剂
B. 干冰能用于人工降雨
C. 碳酸钙是文物陶瓷的主要成分
D. 小苏打是一种膨松剂,可用于制作馒头和面包
答案:C
8.(09浙江卷 28) 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
28) 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。


 相关信息如下:
相关信息如下:
 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解;
 b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:


 请回答下列问题:
请回答下列问题:
 (1)写出装置A中发生反应的离子方程式
。
(1)写出装置A中发生反应的离子方程式
。
 (2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
(2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:

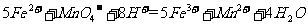
 ①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由
。
①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由
。
 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol·
L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol·
L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
 答案 (1)MnO2
+ 4H+ + 2Cl-
答案 (1)MnO2
+ 4H+ + 2Cl- Mn2+
+ Cl2↑ + 2H2O
Mn2+
+ Cl2↑ + 2H2O
 (2)平衡压强 浓硫酸 使SiCl4 冷凝
(2)平衡压强 浓硫酸 使SiCl4 冷凝
 (3)Al、P、Cl
(3)Al、P、Cl
 (4)①否;KMnO4溶液自身可作指示剂;
(4)①否;KMnO4溶液自身可作指示剂;
 ②4.480%
②4.480%
 解析 制备四氯化硅的原料为Cl2和Si。A装置为Cl2的制备装置,B、C装置为除杂装置。先B除去HCl,再用C(浓H2SO4)除去H2O蒸气。Cl2通入粗硅中反应,用冷水将产生SiCl4冷凝即可。
解析 制备四氯化硅的原料为Cl2和Si。A装置为Cl2的制备装置,B、C装置为除杂装置。先B除去HCl,再用C(浓H2SO4)除去H2O蒸气。Cl2通入粗硅中反应,用冷水将产生SiCl4冷凝即可。
(1)制取氯气用浓盐酸和MnO2在加热条件下反应。
(2)g管是将分液漏斗与烧瓶相连,则它们中的压强是相待的,这样便于盐酸能顺利滴下。SiCl4的沸点很低,只有57.7℃,而反应的温度达几百度,故需要冷凝收集。
(3)从物质的物理性质表可发现,AlCl3,FeCl3和PCl5均易升华,故还应还有Al、P、Cl元素。
(4)由于高锰酸钾本身是紫红色的,与Fe2+反应时,可以褪色,故而可以作为指示剂。根据方程式可以找出关系,5Fe2+~MnO4- ,n(Fe)= 10-2×20×10-3×5×100/25 =4×10-3mol。W (Fe)= 4×10-3×56/5 ×100% =4.48%。

7. (09全国卷Ⅰ29) 已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 ;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
答案 (1)原子晶体。
(2)NO2和N2O4
(3)As2S5。
(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;
②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。
(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
 解析 本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。
解析 本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。
(1)SiO2为原子晶体
(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。
(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。
(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3
> PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形
(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
6. (08年江苏化学·18)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2
+ 6H2O C6H12O6+6O2 b.CO2
+ 3H2
C6H12O6+6O2 b.CO2
+ 3H2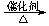 CH3OH +H2O
CH3OH +H2O
c.CO2
+ CH4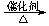 CH3COOH
d.2CO2 + 6H2
CH3COOH
d.2CO2 + 6H2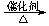 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):

研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即:CO2 HCOOH
HCOOH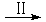 CH4
CH4
①写出产生H2的反应方程式 。
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂 b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂 d.不是催化剂
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
答案:(1)abcd (2)a c
(3)①3Fe+4H2O Fe3O4+2H2 ②c ③e
Fe3O4+2H2 ②c ③e
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com