
3.若数列 满足关系
满足关系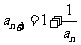 ,且
,且 ,则
,则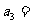 ( )
( )
A.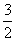 B.
B.  C.
C.  D.
D. 
2.已知正角α的终边上一点的坐标为(sin ,cos ),则角α的最小值为( )
A. B. C. D.高.考.资.源.网
1.设集合 ,
, ,
, .则下列关系中正确的是(
)
.则下列关系中正确的是(
)





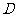
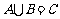
9.(2008年杭州学军中学高考模拟测试5月))某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来制取Mn。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是
。
8.(2008年温州市高三4月适应性测试)将S02通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色;继续滴人BaC12 溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的是
 A . S02 B . Cl- C .
Fe3+
D . N03-
A . S02 B . Cl- C .
Fe3+
D . N03-
6. ((宁波市2008年高考模拟考试))某校课外实验小纰同学设计如图装置进行实验。(夹持装置已略去)
((宁波市2008年高考模拟考试))某校课外实验小纰同学设计如图装置进行实验。(夹持装置已略去)
(1) 该小组同学用该图装置进行“乙炔的制取及燃烧性质验证”实验。
①制取乙炔的化学方程式是 ;
② 点燃乙炔前,必须进行的操作是 。
(2) 该图装置还可用于制取并收集少量其他气体。请帮助该小组同学完成下表。
|
制取的气体 |
药品 |
化学 |
|
O2 |
、
|
|
|
NO |
、
|
|
(3) 该小组同学用该图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是 ,并使视线与凹液面最低处相平。
|
|
饱和的质量 |
金属的质量 |
量气管第一次读数 |
量气管第二次读数 |
|
① |
0.62g |
5.0g(足量) |
40mL |
264mL |
|
② |
0.31g |
2.5g(足量) |
40mL |
152mL |
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
已知该饱和醇的相对分子质量为62。根据上述数据可确定该饱和醇是 元醇;
 其分子式为 。
其分子式为 。
7 (2008年温州市高三4月适应性测试)某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。
 (l)装置A中发生反应的
(l)装置A中发生反应的
化学方程式
(2)若要使B 中收集满干
燥的SO2气休(并证实B
中已收集满),则上述装置
的连接顺序为: 接
接 接
接 (用字母表示)
( 3 ) C 中盛放的试剂是 ,证明B 中己收集满SO2的现象是 (4)待烧瓶中充分反应后,同学们发现铜有剩余。经检测发现硫酸也有剩余.其原因是
;检验硫酸有剩余的方法是 : ( 5 )在不补充浓硫酸的前提下.为使铜进一步溶解,可向烧瓶中加入 (填序号)
① 盐酸 ② FeSO4 ③ Fe 2O3 ④KNO3

4.(杭州第十中学2008学年高三月考)A、B、C、D、E五种有机物,它们的分子分别由-CH3、-OH、-COOH、-C6H5、-CHO中的两种组成,这些化合物的性质如下所述:
(1)A能够发生银镜反应,且相对分子质量为44;
(2)B溶液加入氯化铁溶液中,溶液显紫色;
(3)C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,C和E的相对分子质量之比为8:15;
(4)B和E都能跟氢氧化钠溶液反应,而A、C、D则不能;
(5)D能使酸性高锰酸钾溶液褪色,还能发生硝化反应。
由此可知, C、D、E的结构简式是: C ▲ D ▲ E ▲ 。
答案)C、D、E的结构简式是:(各2分,共6分)
CH3OH,C6H5CH3 ,CH3COOH
3.(杭州第十中学2008学年高三月考))某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应.
(1)在甲酸进行银镜反应前,必须在其中加入一定量的 ▲ ,因为 ▲ .
(2)写出甲酸进行银镜反应的化学方程式 ▲ .
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作 ▲ (写字母):
A、用洁净的试管;
B、在浓度为2%的NH3·H2O中滴入稍过量的浓度为2%的硝酸银;
C、用前几天配制好的银氨溶液;
D、在银氨溶液里加入稍过量的甲酸;
E、用小火对试管直接加热;
F、反应过程中,振荡试管使之充分反应.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:

(4)乙装置中长导管A的作用是 ▲
(5)写出甲酸和甲醇进行酯化反应的化学方程式 ▲
(6)选择甲装置还是乙装置好? ▲ ,原因是 ▲ .
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有 ▲ 、
▲ 两种必备用品.
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释 ▲
Da’an
(1)NaOH,银镜反应必须在碱性条件下进行.
O
(2)H-C-OH+2[Ag(NH3)2]++2OH-→CO2+2Ag↓+4NH3+2H2O
(3)B、C、D、E、F (4)冷凝回流甲醇,平衡内外大气压强.

 (5)HCOOH+CH3OH
(5)HCOOH+CH3OH HCOOCH3+H2O
HCOOCH3+H2O
(6)乙,因为甲醇有毒,需密封操作.
(7)沸石,Na2CO3, (8)甲酸甲酯在在NaOH溶液中发生水解.
2. (严州中学2008第3次模拟)三农问题是政府和社会关注的问题,化肥是土地的营养品。某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL 1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④ ;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)写出步骤④中的实验内容____________________,
写出步骤④中发生反应的离子方程式______________________________。
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是(填字母选项) 。
A. 玻璃棒 B. 托盘天平 C. 烧杯 D. 漏斗
(3)实验中步骤⑤的目的是______________________________。
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为(填字母选项)__________。
A. 50mL,50mL B. 150mL,100mL
C. 100mL,150mL D. 250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为______________________________。(不需要化简)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com