
4.(1)稀氨水和酚酞 ;稀氨水中的NH3气逸出,所以溶液的颜色变浅
(2)溶有SO2的品红 ;SO2气体逸出,品红溶液恢复红色
1. A 2.C 3.B
6.根据下列框图填写下列空格:

(1)C是 ,D是 ,G是 ,E是 。
(2)写出下列反应的离子方程式:
氧化物B+浓盐酸: 。
F的水溶液与E溶液: 。
H与NaOH溶液反应: 。
(3)单质C与浓硫酸共存的现象为: 。
(附答案)
5.在一定条件下,下列各物质可发生如下图所示的变化(反应中生成的水没有写出):
请回答:

(1)固体A是(写出化学式)_______________________。
(2)反应(Ⅰ)的化学方程式为______________________________________________。
(3)反应(Ⅱ)的化学方程式为______________________________________________。
4.某学生课外活动小组利用下图所示装置分别做如下实验:

(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:
_______________________________________________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是:
___________________________________________________________________________。
3.制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( ) A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
2.某种混合气体可能含有N2、HCl和CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜网,经充分反应气体体积又减小,但气体还有剩余。以下对混合气体的组成判断正确的是( )
A.一定没有N2,CO和HCl中至少有一种
B.一定有N2、HCl和CO
C.一定有N2,CO和HCl中至少有一种
D.一定有N2和HCl,没有CO
1.导致下列现象的主要原因与排放SO2有关的是( )
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
3.运用元素单质及其化合物的性质进行物质的推断及检验。
[经典题型]
题型Ⅰ:(07年高考全国卷)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
 (1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离于是_____________________。
(4)由CEF若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离于是_____________________。
(4)由CEF若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
[点拨]本题看似复杂,但有一明显突破口,即溶液E中加氨水、通入空气得红褐色沉淀,此沉淀是Fe(OH)3,由此推断C为单质Fe,F为H2,E为亚铁盐;再往前推,粉状化合物和粉状单质发生置换反应,生成单质铁,应为铝热反应,故B为Al,D为Al2O3,H为NaAlO2,溶液I中含有Na+、Al3+。
答案:(1)H2 (2)4Fe2+ + 8NH3·H2O + O2 + 2H2O = 4Fe(OH)3↓+ 8NH4+
或:Fe2+ + 2NH3·H2O = Fe(OH)2↓+ 2NH4+ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (3)Al3+ 和Na+
(4)H2SO4(或HNO3)
[规律总结]铁作为一种变价金属,是高考命题的热点,在离子共存、离子方程式、金属的腐蚀中铁起着重要的角色,特别是以铁为载体,在化学实验、物质推断和化学计算都有可能出现。
题型Ⅱ:(2006年高考全国卷)下图每一方框中的字母代表一种反应物或生成物:

物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
(1)物质H的化学式是_____________。
(2)反应①的化学方程式是_______________________________________________。
(3)反应②的化学方程式(须注明反应条件)是_______________________________。
[点拨]本题为一综合推断题,突破口为饱和食盐水电解:
2NaCl +2H2O 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
可得A、B、C分别为NaOH、H2、Cl2,根据题意推断C为H2,进而得B为Cl2,A为NaOH,所以H为HCl;由题中表格可知C和D反应的物质的量之比:3C + D = 2I,所以I中应有3个H原子,D为双原子分子N2。
答案:(1)HCl
(2)
(3)

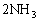
题型Ⅲ:有某白色粉末,取出少量溶于水,用铂丝蘸取溶液做焰色反应实验,焰色呈黄色,再透过钴玻璃观察,焰色呈浅紫色。另取少量粉末加热无明显现象,冷却后加入稀盐酸则逸出无色、无气味的气体,该气体不能使品红溶液褪色,但能与氢氧化钡溶液产生白色沉淀。继续向原反应液中加盐酸至过量,再滴入BaCl2溶液,有白色沉淀生成。则原来的混合物白色粉末中肯定含有的离子是______________。写出有关的离子方程式:_________________________________________________。
[点拨]由颜色反应,肯定白色粉末中含有Na+和K+。由粉末与盐酸反应逸出气体的性质,判断气体是CO2,但可能由CO32-或HCO3-与酸反应而得。粉末加热不产生气体,排除了NaHCO3或KHCO3中的HCO3-。从后一步实验得到难溶于酸的白色钡盐,确定出原粉末中有SO42-.
答案:K+、Na+、CO32-、SO42-;
CO32- + 2H+ =CO2↑+H2O,CO2 + Ba2+ +2OH- = BaCO3↓+ H2O,
SO42- + Ba2+ = BaSO4↓
[随堂作业](45分钟)
2.掌握金属元素单质及其化合物的相互转化关系。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com