
6、用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧气(标准状况),从而可知M的相对原子质量是( )
A.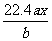 B.
B. C.
C. D.
D.
4、钢铁发生电化学腐蚀时,负极发生的反应是( )
A.2H++2e- → H2 B.2H2O+O2+4e- → 4OH-
C.Fe-2e- → Fe2+ D.4OH--4e- → 2H2O+O2
 5、氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是
5、氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是 H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的PH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
3、用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液的PH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
A.27mg B.54mg C.108mg D.216mg
2、下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
1、在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C. 原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
班级____________ 姓名_____________ 学号_____________ 得分___________
24.(7分)向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,生成了沉淀。如果溶液中C(Ag+)和C(Cl-)的乘积是一个常数,C(Ag+)· C(Cl-)=1.0×10-10,当溶液中C(Ag+)· C(Cl-)>常数,则有沉淀产生,反之沉淀溶解,求
(1)沉淀生成后溶液中C(Ag+)是多少?
(2)如果向沉淀生成后的溶液中再加入50mL0.001mol/L的盐酸,是否产生沉淀,为什么?
23、某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如右图所示;
 (1)求该温度下,中性溶液的pH。
(1)求该温度下,中性溶液的pH。
(2)求该温度下0.01mol/LnaOH溶液的PH
(3)该温度下,pH=a的醋酸溶液与pH=b的NaOH溶液等体积混合,恰好完全反应,
求此醋酸溶液中醋酸的电离度。
22、 水的电离平衡曲线如图所示。
水的电离平衡曲线如图所示。
(1) 若以A点表示25℃时水的电离平衡的离子
浓度,当温度升高到100℃时,水的电离平衡状
态移动到B点,则此时水的离子积
从________变化到_________。
(2) 将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混
合,并保持100℃的恒温,致使混合溶液
的pH=7,则Ba(OH)2和盐酸的体积比为__________________。
(3) 已知AnBm的离子积为[c(Am+)]n[c(Bn-)]m,若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,其离子积约为______________。
三 计算题
21.测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。测定温度______室温(填高于、低于或等于),其理由是 。 将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a︰b 。
(2)若所得混合液的pH=2,则a︰b 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com