
11.(15分)结构的研究是有机化学最重要的研究领域。某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如右:(其中Ⅰ、
 Ⅱ为未知部分的结构)。为推测X的分
Ⅱ为未知部分的结构)。为推测X的分
子结构,进行如右图转化:
 已知向D的水溶液中滴入FeCl3
已知向D的水溶液中滴入FeCl3
溶液显紫色,对D的结构进行光谱
分析,在氢核磁共振谱上显示只有两
种信号。M、N互为同分异构体,M
中含有一个六原子环,N能使溴的四
氯化碳溶液褪色,G能与NaHCO3溶
液反应。请回答:
(1)G分子所含官能团的名称是_▲_;
(2)D不可以发生的反应有(选填序号)_▲_;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出右图转化中反应①和②的化学方程式
①B+F→M_▲_;②G→N_▲_;
(4)已知向X中加入FeCl3溶液,无明显现象,则X的结构简式是_▲_;该结构的1mol X与足量的NaOH溶液作用,最多可消耗NaOH_▲_mol。
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基,则W的分子结构有_▲_种,写出任意一种的结构简式_▲_。
10.(16分) △
(1)2NH4C1+Ca(OH)2 CaC12+2NH3↑+2H2O
3分
(2)吸收水蒸汽 (2分)
(3)用湿润的红色石蕊试纸靠近a处,如试纸变为兰色,则F中已充满氨气(或用玻璃棒蘸取浓盐酸靠近a处,如产生白烟,则F中已充满氨气)(3分)
(4)②防止发生倒吸现象 (2分)
(5)关闭K5打开K3轻轻挤压塑料瓶D,然后打开K5[或找开K1和K5用手,(或热毛巾或冷毛巾)将烧瓶捂住 (3分) (1/Vm) (3分)
10.(16分)下图是实验室制取某种气体的制备、性质检验及收集装置图。

(1)写出图中A中反应的化学方程式 。
(2)B装置的作用是 。
(3)做喷泉实验前。要检验F装置是否充满气体,该澡作及现象是 。
(4)做喷泉实验时要关闭K2和K4打开K1,此时C装置的作用有两点:
①吸收多余的气体体保持气流通畅;
② 。
(5)验满气体后,关闭K2和K4打开K1若要在E中引发喷泉其操作为 ;假设液体充满整个烧瓶,所得溶液的物质的量浓度为 。
9.(15分)(1)0.16(2分) (2)>(3分),<(3分)
(3)b=2a>l(3分),(或a>0.5,b=2a;或b>1,b=2a),0.167(2分)
(4)B、C(2分)
9.(15分)现将水蒸汽和CO气体分别通入到体积为1L的恒容密闭容器中进行反应。H2O(g)+CO(g)
 CO2(g)+H2(g);△H。得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);△H。得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO2 |
|||
|
1 |
650℃ |
1mol |
2mol |
0.8mol |
0.8mol |
5min |
|
2 |
900℃ |
0.5mol |
1mol |
0.2mol |
0.2mol |
3min |
|
3 |
900℃ |
a mol |
b mol |
c mol |
d mol |
t |
(1)由以上数据,实验1中以v(CO2)表示的反应速率为 mol/(L·min)。
(2)比较该反应实验1和实验2中CO的转化率:
 ;该反应的反应热△H 0。(两空填“>”、“=”或“<”)
;该反应的反应热△H 0。(两空填“>”、“=”或“<”)
(3)若实验3要达到与实验2等效的平衡状态,且t<3 min,则a、b应满足的关系是 ,实验3条件时反应的平衡常数为 。
(4)900℃时,若要重新达到平衡,使c(CO2)/c(CO)比值变小,在其他条件不变时,可采取的措施有(填字母) 。
A.使用高效催化剂 B.增大H2浓度 C.升高温度 D.缩小容器体积
8、(14分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。
请回答下列问题: (1)Y、Z、W的原子半径由小到大的顺序是
。(用元素符号表示)
(2)ZW2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体
(3)工业生产单质Y的原理用化学方程式可以表示为是
。
(4)X与Y化学性质相似,其对应的钠盐是易溶于水,则X与浓的NaOH溶液反应的离子方程式是
。
(5)0.1 mol的单质W与100 mL 0.8 mol/L的FeBr2溶液反应,则被氧化的Fe2+ 和Br- 的物质的量之比是
。
(1)Y、Z、W的原子半径由小到大的顺序是
。(用元素符号表示)
(2)ZW2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体
(3)工业生产单质Y的原理用化学方程式可以表示为是
。
(4)X与Y化学性质相似,其对应的钠盐是易溶于水,则X与浓的NaOH溶液反应的离子方程式是
。
(5)0.1 mol的单质W与100 mL 0.8 mol/L的FeBr2溶液反应,则被氧化的Fe2+ 和Br- 的物质的量之比是
。
|
|
|
|
|
|
|
|
|
|
|
(3)2Al2O3 ==== 4Al+3O2↑ (3分)(4)Be+2OH-=BeO22-+H2↑(3分)
(5)2∶3 (2分)
7.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。

 下列有关说法正确的是A
下列有关说法正确的是A
 A.大量的氮、磷废水排入海洋,易引发赤潮
A.大量的氮、磷废水排入海洋,易引发赤潮
 B.工段②中结晶出的MgCl2·
6H2O可在空气中受热分解制无水MgCl2
B.工段②中结晶出的MgCl2·
6H2O可在空气中受热分解制无水MgCl2
 C.在工段③④⑤中溴元素均被氧化
C.在工段③④⑤中溴元素均被氧化
 D.工段①中除去粗盐中的SO42-、Ca2+ 、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
D.工段①中除去粗盐中的SO42-、Ca2+ 、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
6.著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是D
 A.电解熔融CeO2制Ce,铈在阳极获得
A.电解熔融CeO2制Ce,铈在阳极获得

 B.铈溶于氢碘酸的化学方程式可表示为:Ce +
4HI CeI4+2H2↑
B.铈溶于氢碘酸的化学方程式可表示为:Ce +
4HI CeI4+2H2↑
 C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
 D.四种稳定的核素
D.四种稳定的核素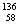 Ce、
Ce、 Ce、
Ce、 Ce、
Ce、 Ce ,它们互称为同位素
Ce ,它们互称为同位素
5.已知25℃时,AgⅠ饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KⅠ浓度均为0.01mol·L-1的混合溶液中,滴加8mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是A
A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(Ⅰ-)
B.溶液中先产生的是AgⅠ沉淀
C.AgCl的KSP的数值为1.69×10-10
D.若在AgCl悬浊液中滴加KⅠ溶液,白色沉淀会转变成黄色沉淀
4.已知25℃时, 某酸
某酸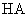 与
与
 等体积混合,溶液
等体积混合,溶液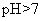 ;含等物质的量的
;含等物质的量的 和
和 混合液
混合液 。该温度下,在物质的量浓度均为
。该温度下,在物质的量浓度均为 的
的 和
和 混合溶液中,下列排序一定正确的是( C
)
混合溶液中,下列排序一定正确的是( C
)
A.
B.
C.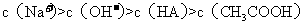
D.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com