
5、阿伏加德罗定律是指“在相同温度和压强下,相同体积的任何气体都______________________;由阿伏加德罗定律可以推导出,在相同的温度和压强下:
(1)同体积的两种气体的质量与式量关系为________________________________________。
(2)两种气体的体积与物质的量的关系为___________________________________________。
(3)两种气体等质量时,体积与式量关系为_________________________________________。
4、气体体积的大小主要取决于_________________、______________、_______________三大因素,其中_________________的大小主要取决于温度和压强。
3、同温同压下,同体积的氨气和硫化氢气体的质量比为_____________;同质量的氨气和硫化氢气体的的体积比为____________,其中含有氢原子的个数比为_____________;若氨气和硫化氢气体中氢原子个数相同,则它们的体积比为__________________。
2、标准状况下,450mL某气体的质量为0.5625g,该气体的式量为______________,可能是________________或是________________气体。
1、标准状况下,1 mol氧气所占的体积约为_________L,1 mol氢气所占的体积约为__________L,那么0.5mol氧气和0.5mol氢气的混合气体所占体积约为___________L,5L该混合气体的质量为_____________g。
14.在室温下,向100mL
Cu(IO3)2饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应: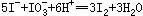 、
、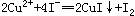 ,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定,
,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定, ,消耗了40 mL Na2S2O3溶液,计算:
,消耗了40 mL Na2S2O3溶液,计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的密度为1.0 g/cm3,室温时Cu(IO3)2的溶解度是多少?
13.实验室制取SO2的反应原理为:
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
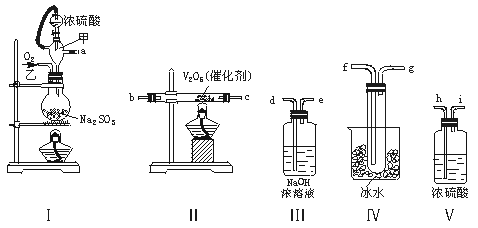
(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
12.甲、乙两相邻的化工厂,排放的污水经处理后,仍然各溶有以下八种离子(Ag+、Fe3+、Ba2+、Na+、Cl-、SO42-、NO3-、OH-)中各不相同的 4种,若单独排放,则造成环境污染,如果将甲、乙两厂的污水按适当比例充分混合,再经沉淀后,排放的污水转变为无色澄清的NaNO3溶液,污染程度大为降低,又经测定,甲厂污水的pH大于7,试推断:
(l)甲厂污水中含有的4种离子是 ;
(2)乙厂污水中含有的4种离子是 .
11.防治碘缺乏病的碘添加剂是KIO3(如加碘盐),可用盐酸酸化的KI淀粉混合液检验食盐
是否加碘,其反应的离子方程式为:
10.下列关于SO2的叙述,正确的是A
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫酸的酸酐
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com