
3.判断共价键的极性、分子的极性和分子构型;
2.用电子式表示化学键形成的过程;
1.判断化学键的类型;
8.各类晶体主要特征
|
类型 比较 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
|
构成晶体微粒 |
阴、阳离子 |
原子 |
分子 |
金属阳离子、自由电子 |
|
|
形成晶体作用力 |
离子键 |
共价键 |
范德华力 |
微粒间的静电作用 |
|
|
物理性质 |
熔沸点 |
较高 |
很高 |
低 |
有高、有低 |
|
硬度 |
硬而脆 |
大 |
小 |
有高、有低 |
|
|
导电性 |
不良(熔融或水溶液中导电) |
绝缘、半导体 |
不良 |
良导体 |
|
|
传热性 |
不良 |
不良 |
不良 |
良 |
|
|
延展性 |
不良 |
不良 |
不良 |
良 |
|
|
溶解性 |
易溶于极性溶剂,难溶于有机溶剂 |
不溶于任何溶剂 |
极性分子易溶于极性溶剂;非极性分子易溶于非极性溶剂中 |
一般不溶于溶剂,钠等可与水、醇类、酸类反应 |
|
|
典型实例 |
NaOH、NaCl |
金刚石 |
P4、干冰、硫 |
钠、铝、铁 |
在离子晶体、原子晶体和金属晶体中均不存在分子,因此NaCl、SiO2等均为化学式。只有分子晶体中才存在分子。
7.物质熔沸点高低比较规律
(1)不同晶体类型的物质的熔沸点高低顺序一般是:原子晶体>离子晶体>分子晶
体。同一晶体类型的物质,则晶体内部结构粒子间的作用越强,熔沸点越高。
(2)原子晶体要比较共价键的强弱,一般地说,原子半径越小,形成的共价键的键长越短,
键能越大,其晶体熔沸点越高。如熔点:金刚石>碳化硅>晶体硅
(3)离子晶体要比较离子键的强弱。一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。
(4)分子晶体:组成和结构相似的物质,相对分子质量越大,熔沸点越高,如:熔沸点:O2>N2,HI>HBr>HCl。组成和结构不相似的物质,分子极性越大,其熔沸点就越高,如熔沸点CO>N2。在同分异构体中,一般地说,支链数越多,熔沸点越低,如沸点:正戊烷>异戊烷>新戊烷;同分异构体的芳香烃及其衍生物,其熔沸点高低顺序是邻>间>对位化合物。
(5)金属晶体中金属离子半径越小,离子电荷数越多,其金属键越强,金属熔沸点就越高。
(6)元素周期表中第ⅦA族卤素的单质(分子晶体)的熔沸点随原子序数递增而升高;第IA
族碱金属元素的单质(金属晶体)的熔沸点随原子序数的递增而降低。
6.化学键与物质类别关系规律
(1)只含非极性共价键的物质:同种非金属元素构成的单质,如:I2、N2、P4、金刚石、晶体硅等。
(2)只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。如:HCl、NH3、SIO2、CS2等。
(3)既有极性键又有非极性键的物质,如:H2O2、C2H2、CH3CH3、C6H6(苯)等。
(4)只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如:Na2S、CSCl、K2O、NaH等。
(5)既有离子键又有非极性键的物质,如:Na2O2、Na2Sx、CaC2等。
(6)由离子键、共价键、配位键构成的物质,如:NH4Cl等。
(7)由强极性键构成但又不是强电解质的物质:HF。
(8)只含有共价键而无范德华力的化合物,如:原子晶体SIO2、SIC等。
(9)无化学键的物质:稀有气体,如氩等。
4、表示原子结构的方法
①原子结构示意图;②离子结构示意图;③电子式:原子、分子、离子化合物、共价化合物;④结构式。
化学键
在原子结合成分子时,相邻的两个或多个原子(离子)之间的强烈的相互作用,叫做化学键。化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程。
⑴概念
 离子键
使阴阳离子结合成化合物的静电作用(平衡、多角)
离子键
使阴阳离子结合成化合物的静电作用(平衡、多角)
 化学键
非极性键
(同种原子形成,共用电子对不偏移)
化学键
非极性键
(同种原子形成,共用电子对不偏移)
共价键 原子间通过共用电子对所形成的相互作用
极性键 (不同种原子间形成,电子对发生偏移)
⑵比较
|
键型 |
成键方式 |
存在范围 |
成键粒子 |
|
离子键 |
离子键 |
离子化合物 |
阴阳离子 |
|
共价键 |
共价键 |
离子、共价化合物 |
原子 |
|
联系 |
离子键是最强的极性键,非极性键是最弱的极性键 |
⑶化学反应过程键及能量变化
化学反应过程=破坏旧键过程(消耗能量)+形成新键过程(释放能量)
3、核外电子运动特征:电子云
多电子原子里,电子分层排布:K、L、M、N、O、P、Q……;
电子按能量由低向高依次从内层向外层排布;
每个电子层所能容纳的电子不超过2n2个;最外层电子不能超过8个;次外层电子不能超过18个;倒数第三层电子不能超过32个。
2、同位素
质子数相同而中子数不同的同一元素的不同原子互称同位素。
同一元素的同位素:
①化学性质基本相同;②各自所占的原子个数百分比保持一定。
核外电子排布
1.原子组成和结构
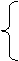 原子核:质子(Z)、中子(A-Z)
原子核:质子(Z)、中子(A-Z)
原子 X
X
核外电子(Z)
原子:质子数=核电荷数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
离子:阴离子 质子数<核外电子数
阳离子 质子数>核包外电子数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com