
7.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离水分子填充,则天然气水合物的平均组成可表示为
A.CH4·14H2O B.CH4·8H2O
C.CH4·7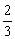 H2O D.CH4·6H2O
H2O D.CH4·6H2O
6. 在氯化钠晶体晶胞中,与每个Na+距离最近且等距离的几个Cl-所围成的空间的构型为( )
A. 正四面体形 B. 正八面体形
C. 正六面体形 D. 三角锥形
5. 元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A. 分子晶体 B. 原子晶体
C. 离子晶体 D. 金属晶体
4. X元素原子的质量数为m,核内中子数为n,则w g X+含有电子的物质的量为( )
A. 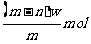 B.
B.

C. 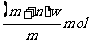 D.
D. 
3. 下列说法中,正确的是( )
A. 周期表中的主族都有非金属元素
B. 周期表中的主族都有金属元素
C. 周期表中的非金属元素都位于主族
D. 周期表中的非金属元素都位于短周期
2. 物质发生化学变化时:(1)电子总数(2)原子总数(3)分子总数(4)物质的种类(5)物质的总质量(6)物质的总能量,反应前后肯定不会发生变化的是( )
A. (1)(2)(3)(5)
B. (1)(2)(5)
C. (2)(5)(6)
D. (1)(4)(5)(6)
1. 下列说法中不正确的是( )
A. 离子晶体中不一定含有金属元素
B. 由不同原子所形成的纯净物一定是化合物
C. 在含有阳离子的化合物晶体中,一定含有阴离子
D. 含有金属元素的离子不一定是阳离子
6.分析晶体中的粒子数及空间结构。
典题分析:
例1.(08全国Ⅰ卷)下列化合物,按其品体的熔点由高到低排列正确的是( )
A.SiO2 CaCl CBr4 CF2 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
解析:物质的熔点的高低与晶体的类型有关,一般来说:原子晶体>离子晶体>分子晶体;即:SiO2>CsCl>CBr4、CF4。当晶体的类型相同时,原子晶体与原子半径有关;离子晶体与离子的半径和离子所带的电荷有关;分子晶体当组成和结构相似时,与相对分子质量的大小有关,一般来说,相对分子质量大的,熔点高,即CBr4>CF4。
答案:A。
例2、(08全国Ⅰ卷)下列各组给定原子序数的元素,不能形成原子数之比为1∶1稳定化合物的是( )
A.3和17 B.1和8 C.1和6 D.7和12
解析:此题应根据已知的原子序数确定对应的元素,然后根据常见的物质进行判断。选项A中可形成LiCl;选项B中可形成H2O2;选项C中可形成C2H2;选项D中可形成Mg3N2。
答案:D。
例3.(08全国Ⅰ卷)下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、Hl的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
解析:分子的极性一般与物质的空间结构有关,空间结构对称,这属于非极性分子,反之属于极性分子,对于ABn分子,其经验规则是中心原子A的化合价的绝对值若等于最外层电子数,则属于非极性分子,反之属于极性分子。当然根据分子的极性也可以判断它的空间结构。键的极性只与是否属于同种非金属有关,而物质的稳定性当结构相似的条件下,与原子半径有关。所以选项A中CO2属于非极性分子;选项C中HF、HCl、HBr、HI的稳定性减弱;选项D中的H2O属于V型结构。
答案:B。
例4.(08广东卷)2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于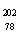 Pt的说法正确的是( )
Pt的说法正确的是( )
A. 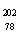 Pt和
Pt和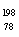 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B. 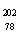 Pt和
Pt和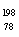 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C. 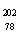 Pt和
Pt和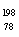 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D. 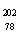 Pt和
Pt和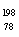 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
解析:同位素定义:质子数相同,中子数不同的核素称为同位素。
答案:A
例5.(08四川卷)下列说法中正确的是( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
解析:选项A中离子晶体中每个离子周围吸引带相反电荷的离子与离子半径有关,如一个Cs+可同时吸引8个Cl-;选项B中金属内部的自由电子不是在电场力的作用下产生的;选项C中分子晶体的熔沸点很低,在常温下也有呈固态的,如S,属于分子晶体,但它在常温下为固态。
答案:D。
例6、(2007江苏4)下列说法正确的是[ ]
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
解析:原子晶体中有的只含有非极性共价键,如金刚石、晶体硅,多为单质;也有含极性键的,如SiO2,BN等,A不正确。干冰升华是物理性质中状态的改变,变化的是分子间的距离,分子内的共价键没有断裂。D项中常见的反例为AlCl3,由金属和非金属构成的共价化合物,注意由非金属构成的化合物不一定是共价化合物,如铵盐。
答案:B
例7、(2007上海15)下列有关化学键与晶体结构说法正确的是
A 两种元素组成的分子中一定只有极性键
B 离子化合物的熔点一定比共价化合物的高
C 非金属元素组成的化合物一定是共价化合物
D 含有阴离子的化合物一定含有阳离子
解析:本题考查的是化学键知识。两种元素组成的分子中也可以有非极性键,如双氧水,故A错;晶体熔沸点顺序一般为:原子晶体>离子晶体>分子晶体,共价化合物多数是分子晶体,但也有些是原子晶体如二氧化硅,故B错;非金属元素组成的化合物多数是共价化合物,但也可以形成离子化合物,如铵盐,故C错;由电荷守恒可只,D正确。
答案:D
例8.下列离子中,电子数大于质子数且质子数大于中子数的是( )
A. D3O+ B. Li+ C. OD- D. OH-
解析:对于中性微粒,质子数等于电子数;对于阳离子,由于失电子,造成质子数大于电子数;对于阴离子,质子数小于电子数。“电子数大于质子数”的只可能为C、D,但能满足“质子数大于中子数”的只有D。
答案:D
例9. 下列说法中正确的是( )
A. 氢键是一种强度介于离子键和共价键之间的化学键
B. 所有物质中都存在化学键
C. 含有极性键的分子一定是极性分子
D. 含有离子键的化合物一定是离子化合物
解析:此题考查晶型与键型之间的关系。(特例验证法)
A项:氢键不是化学键,化学键有:离子键、共价键、金属键三种,则A错误;B项:惰性单质是单原子分子,只存在分子间作用力,分子内部没有化学键,则B错误;C项:CH4是含有极性键的非极性分子,所以此说法错误;D项:含有离子键的化合物一定是离子化合物,则D正确。
答案:D。
例10.下列说法错误的是( )
A. 原子晶体中只存在非极性共价键
B. 分子晶体的状态变化,只需克服分子间作用力
C. 金属晶体通常具有良好的导电、导热和延展性
D. 离子晶体在熔化状态下能导电
解析:原子晶体中,有的是单质,原子间存在非极性共价键;有的是化合物,原子间存在极性共价键。分子晶体微粒间只存在分子间作用力。金属晶体内存在自由电子,因而能导电、导热,并具有延展性。离子晶体在熔化状态下,离子能自由移动,因而能导电,答案为A。
答案:A
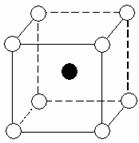
例11. 下图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g/mol,则氯化铯晶体的密度为( )
A. 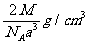 B.
B.
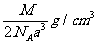
C. 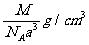 D.
D.
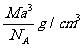
解析:以小立方体为研究对象:体积为a3 cm3,铯离子个数为
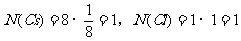
所以,小立方体中只含有1个氯化铯。
根据摩尔质量求得1个氯化铯的质量为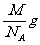 。由体积、密度、质量的关系得:C项正确。
。由体积、密度、质量的关系得:C项正确。
答案:C。
例12. 下列各组物质各自形成的晶体,都属于分子晶体的化合物的是( )
A. H2O、HD、C3H8
B. P2O5、CO2、H3PO4
C. SO2、SiO2、CS2
D. CCl4、(NH4)2S、H2O2
解析:本题的关键是审题要细心。HD是氢气,A错;SiO2为原子晶体,C错;(NH4)2S为离子晶体,D错。
答案:B。
例13. 下列物质中,只含离子键的是( )
A. NaOH B. NaCL C. AlCl3 D. Na2O2
解析:A中,NaOH既含离子键,又含极性共价键;B中,NaCl只含离子键;C中,AlCl3虽然含有金属元素,但Al与Cl之间存在的是共价键;D中,Na2O2既含离子键,又含非极性共价键。
答案:B。
例14. 下列微粒半径的大小关系,不正确的是( )
A.Na>Be>C>F B. S2->S>O>F
C. S2->Cl->K+>Ca2+ D. Cl>Li>N>He
解析:A中,Na原子半径大于Li,Li大于Be,Be、C、F在周期表中同周期,A正确。B中,S、O同主族,O、F同周期,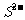 半径大于S原子半径,B正确。C中,四者的电子层结构相同,核电荷数依次增大,半径依次减小,C正确。D中,虽然Cl的电子层数比Li多,但半径却比Li小,N的原子半径也小于He的原子半径,D不正确。
半径大于S原子半径,B正确。C中,四者的电子层结构相同,核电荷数依次增大,半径依次减小,C正确。D中,虽然Cl的电子层数比Li多,但半径却比Li小,N的原子半径也小于He的原子半径,D不正确。
答案:D。
例10. PtCl2(NH2)2有两种分子结构,它可以形成两种固体。实验发现:一种固体为淡黄色,另一种固体为黄绿色。
做溶解性实验发现,淡黄色固体在水中溶解度很小,而在汽油中溶解度较大;黄绿色固体易溶于水,而难溶于汽油。
根据上述实验现象推断两种固体的分子构型:
淡黄色固体:______________________;
黄绿色固体:______________________。
解析:水是极性分子,淡黄色固体在水中溶解度小,说明其为非极性分子;黄绿色固体易溶于水,说明其为极性分子。
答案为:淡黄色固体为: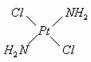
黄绿色固体为: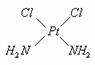 (都为平面结构)
(都为平面结构)
演练提高
5.根据晶体的性质,推断晶体类型;
4.根据晶体结构比较晶体的有关性质;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com