
1、 已知函数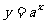 和
和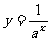 ,其中
,其中 且
且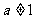 ,则它们的反函数的图像关于
,则它们的反函数的图像关于
A. 轴对称 B.
轴对称 B. 轴对称 C.直线
轴对称 C.直线 对称 D.原点对称
对称 D.原点对称
11.(15分)

(1) (每个1分,共3分)

(2) (3分)
(3)① b d(选对1个2分,全对3分,多于答案数0分)

②
(3分)
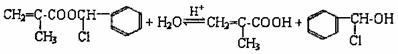 (4)
(4)
(3分)

11.(15分)己知:
 ①同一个碳原子上同时连接两个或两个以上羟基的结构是不稳定结构,具有这种结构的物质会按以下方式自去失水
①同一个碳原子上同时连接两个或两个以上羟基的结构是不稳定结构,具有这种结构的物质会按以下方式自去失水

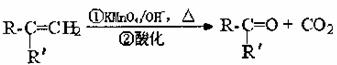
② (R、R′可表示烃基或官能团)
A可发生如下转化,B含有一个支链,C能与NaHCO3溶液反应,E是芳香族化合物且能发生银镜反应。(方框内物质均为稳定存在的有机物,部分无机产物已略去)
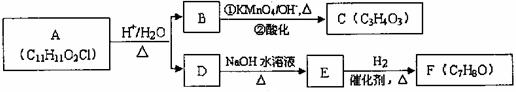
请根据以上信息回答下列问题。 
(1)F的同分异构体很多,其中遇FeCl3溶液呈紫色的F的所有同分异构体的结构简式有 。
(2)C的结构简式是 。
(3)若C与氢气发生加成反应的产物为G,则:
①G不可能发生的化学反应类型有 。(填序叫)
a.取代反应 b.加成反应 c.氧化反应 d.水解反应 e.消去反应
②写出G在一定条件下反应生成六元环状酯的化学方程式 。
(4)A→B+D的化学方程式是 。
10、答案; (15分)(1) 2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑(4分)
(2)Al - 3e- + 4OH- == AlO2- + 2H2O(4分)(系数加倍也是正确的)
(3)30.8 %(4分) (4)9.75 g(3分)
10、(15分)某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如下图所示:
 实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50 mL 5.0 mol · L-1 NaOH溶液的烧杯中。试回答下列问题:
实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50 mL 5.0 mol · L-1 NaOH溶液的烧杯中。试回答下列问题:
(1)合金表面反应的离子方程式为:
。
(2)合金表面会形成原电池,其负极的电极反应为:
。
(3)不同时间电子天平的读数如下表所示:
|
实验操作过程 |
时间 / min |
电子天平的读数
/ g |
|
烧杯 + NaOH溶液 |
|
80.0 |
|
烧杯 + 溶液 + 样品 |
0 |
87.8 |
|
1 |
87.5 |
|
|
2 |
87.3 |
|
|
3 |
87.2 |
|
|
4 |
87.2 |
则合金中铁的质量分数为 (保留三位有效数字,下同)。
(4)上述50 mL NaOH溶液中最多可溶解的铁铝合金样品质量为 。
9.(10分)
(1)ABC(2分,漏选得1分,有错选的不得分);
(2)①甲烷来源丰富制氢成本低;②甲烷比其它烃的含氢量高,等质量烃制氢时用甲烷的收率是最高的(2分,答出其中一点即可)。
(3)高温有利于提高反应速率,过高压水蒸气条件下CO转化率增大,且二氧化碳在水中的溶解度也增大(答出其中两点即可,2分);
(4)①充分利用原料气中的CO和H2;②常温常压下合成可节约能源,经济效益高;③实现循环生产,符合绿色化学理念(答出其中一点即可,2分)
(5)1.35(2分)
9.(10分)氢气将会成为21世纪最理想的能源又是重要的化工原料,用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  CO(g)+2H2(g);△H=-36kJ/mol……………………………①
CO(g)+2H2(g);△H=-36kJ/mol……………………………①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H=+216kJ/mol………………………………②
CO(g)+3H2(g);△H=+216kJ/mol………………………………②
(1)下列说法不正确的是 ▲ 。
A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6∶1
(2)工业上常采用甲烷与水蒸气作用制氢气,为何不用其他的烃与水蒸气作用制取氢气? ▲ 。
 (3)工业上将CH4和水蒸气反应后的混合气体,再进行CO(g)+H2O(g) H2 (g)+CO2(g)
△H<0,再在1000℃下,用过高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高压高温处理的理由是:
▲
。
(3)工业上将CH4和水蒸气反应后的混合气体,再进行CO(g)+H2O(g) H2 (g)+CO2(g)
△H<0,再在1000℃下,用过高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高压高温处理的理由是:
▲
。
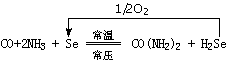 (4)某研究机构拟利用反应②产生的原料气,先分离出H2合成氨,再利用下列反应合成尿素:
(4)某研究机构拟利用反应②产生的原料气,先分离出H2合成氨,再利用下列反应合成尿素:
该工艺的优点是 ▲ (列举一条)。
 (5)某温度下,在100L反应器中充入甲烷和水蒸汽的分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 ▲
。
(5)某温度下,在100L反应器中充入甲烷和水蒸汽的分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 ▲
。
8. (16分)
(16分)
(1)极性, (各2分,共4分)
(2)H2O>NH3>CH4(2分)
(3)HNO3>H3PO4>H2SiO3(3分)
|
(4)SiO2+2C Si+2CO↑(3分) 原子(2分)
(5)气体颜色先变深然后逐渐变浅,达到新的平衡后,体系气体颜色较原体系气体颜色深(2分)(合理答案同等给分)
8.(16分) 已知A、B、c、D、E为原子序数依次增大的五种短周期元素。其中A与D、B与E同主族,C元素的最外层电子数是内层电子数的3倍,D元素在地壳中的含量仅次于氧,D的单质是良好的半导体材料,E元素的最高正价与最低负价的代数和为2。试回答:
(1)E元素的氢化物是 分子(填“极性”或“非极性”),电子式是 。
(2)A、B、C三种元素形成的氢化物的熔点由高到低的顺序是 。(用化学式表示)
 (3)B、D、E三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是
。(用化学式表示)
(3)B、D、E三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是
。(用化学式表示)

|

 (5)B、C两元素形成的化合物在密闭容器中存在反应:2BC2(g) B2C4(g);△H<O。达到平衡后,保持温度不变,缩小容器体积为原来的1/2,可观察到的现象是
。
(5)B、C两元素形成的化合物在密闭容器中存在反应:2BC2(g) B2C4(g);△H<O。达到平衡后,保持温度不变,缩小容器体积为原来的1/2,可观察到的现象是
。
7、已知某温度下,0.1mol·L-1的NaHB强电解质溶液中[H+]>[OH-],则下列关系式一定正确的是:( B )
a+)=c(HB-)+2c(B2-)+c(OH-) B. c(Na+)=0.1mol·L-1≥c(B2-)
C.c(H+)·c(OH-)=1×10-14 D.溶液的pH=1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com