
1.如图所示,D是△ABC的边AB的中点,则向量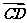 =
( )
=
( )
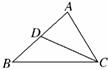 A.-
A.-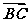 +
+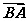 B.-
B.-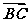 -
-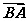
C.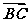 -
-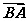 D.
D. 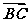 +
+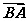
22、(6分)为测定某镁铝合金的成分,取14.7g合金完全溶于500mL3mol·L-1的硫酸中,现加入400mL 8mol·L-1的NaOH溶液充分反应,得到白色沉淀。
1)、 若只有一种沉淀,试确定合金中镁的质量分数范围。
2)、若沉淀质量为26.3g,则镁的质量分数为多少?
江西省南昌市铁路一中高2011级高三10月月考
21.(14分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
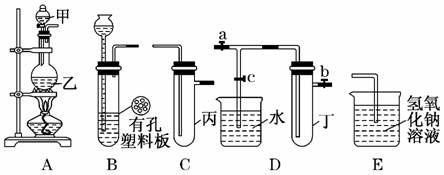
请按要求填空:
(1)利用B装置可制取的气体有____________(写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
|
实验序号 |
实验操作 |
现象 |
结论 |
|
Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
|
Ⅱ |
氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应的产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由________________
________________________________________________________________________.
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛放的试剂、实验现象及结论)__________________________________________
________________________________________________________________________.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为______________________________________
________________________________________________________________________.
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是________________.
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的氧气,直到试管全部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算).
20.(8分)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
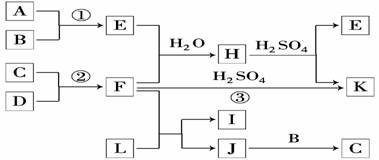
已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.
(b)反应①、②是化工生产中的重要反应.
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.
(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.
(e)化合物J由两种元素组成,其相对分子质量为32.
请按要求填空:
(1)反应③的化学方程式_______________________________________________.
(2)C的结构式__________________________;H的化学式____________________.
(3)L的溶液与化合物E反应的离子方程式:____________________________.
(4)化合物J的化学式____________________.
19.(8分)已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
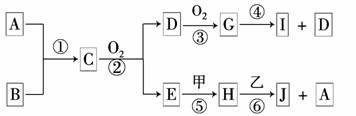
(1)写出反应②的化学方程式_________________________________________
(2)反应④中每消耗1 mol G,转移电子的物质的量为______________.
(3)反应⑥的离子方程式是___________________________________________.
(4)实验室中保存I的方法是____________________________________________.
18.(6分)A、B、C、D、E为短周期的五种元素,它们原子序数依次递增,B是构成有机物的主要元素;A与C可形成10电子化合物W,它可使紫色石蕊试液变蓝;D元素的原子最外层电子数是其次外层电子数3倍;E是同周期元素中原子半径最大的元素;A、B、C、D可形成化合物X,在X晶体中阳离子与阴离子个数比为1∶1;A、D、E可形成化合物Y。A、C、D可形成离子化合物Z。
回答下列问题:
⑴Y的电子式: ;W的空间构型: ;
⑵写出Z的水溶液中各离子浓度由大到小的顺序: ;
⑶写出常温下X与足量的Y在溶液中反应的离子方程式: 。
17.(10分)硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:
(1)向大气中排放NOx可能导致的环境问题有____________________.(答两点)已知足量NaOH溶液能完全吸收NO2生成氮的含氧酸盐.试写出该反应的离子方程式___________________.
(2)光导纤维的作用,让人们的生活更加丰富精彩,____________是制备光导纤维的基本原料.
(3)氮化硅陶瓷是一种新型无机非金属材料,其化学式为__________,可由硅粉(用Al2O3和Y2O3作助剂)在氮气中高温烧结而成,氮气在反应中既是反应物,同时又起了______________作用.由于使用的硅粉表面含二氧化硅,在反应中需加入碳粉.在烧结过程中,二氧化硅、碳、氮气以物质的量之比3∶6∶2反应生成两种化合物,该反应的化学方程式为___________________________________.
(4)硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源.与“氢能源”比较“硅能源”具有________________________________等更加优越的特点,从而得到全球的关注和期待.
16.将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是 ( )
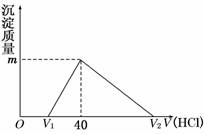
A.原合金质量为0.92 g B.标准状况下产生氢气896 mL
C.图中m值为1.56 g D.图中V2为60 mL
15.下列示意图与对应的反应情况正确的是 ( )
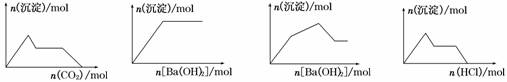
A B C D
A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.NaHSO4溶液中逐滴加入Ba(OH)2溶液
C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D.NaAlO2溶液中逐滴加入盐酸
14.1.92 g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为 ( )
A.504 mL B.336 mL C.224 mL D.168 mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com