
12.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上产生大量气泡。则四种金属的活动性顺序由强到弱的是 ( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
[答案] B
11.对于锌-铜-稀H2SO4组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是 ( )
①锌片溶解了32.5 g ②锌片增重32.5 g ③铜片上析出1 gH2 ④铜片上析出1 mol H2
A.①③ B.①④
C.②③
D .②④
.②④
[答案] A
10.(2009·芜湖模拟)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电,高铁电池的总反应为:
3Zn+2K2FeO4+8H2O放电充电3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是 ( )
 A.放电时每转移3
mol电子,正极有1 molK2FeO4被氧化
A.放电时每转移3
mol电子,正极有1 molK2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO+4H2O
C.放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
D.放电时正极附近溶液的碱性增强
解析:由电池的总反应可知放电时:正极反应为FeO+3e-+4H2O===Fe(OH)3+5OH-,负极反应为Zn-2e-+2OH-===Zn(OH)2,此时K2FeO4得电子被还原,A项错误,C、D正确,充电时阳极反应为放电时正极反应的逆过程,B项正确。
答案:A
9.(2009·重庆模拟)有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
|
实验次数 |
电极材料 |
水果品种 |
电极间距/cm |
电压/mV |
|
|
1 |
锌 |
铜 |
菠萝 |
3 |
900 |
|
2 |
锌 |
铜 |
苹果 |
3 |
650 |
|
3 |
锌 |
铜 |
桔子 |
3 |
850 |
|
4 |
锌 |
铜 |
西红柿 |
3 |
750 |
|
5 |
锌 |
铝 |
菠萝 |
3 |
650 |
|
6 |
锌 |
铝 |
苹果 |
3 |
450 |
甲同学提出的问题,乙同学解释不正确的是 ( )

|
|
甲同学 |
乙同学 |
|
A |
实验6中的负极电极反应式如何写? |
铝为负极:Al-3 e-===Al3+ e-===Al3+ |
|
B |
实验1和实验5电流方向为什么相反? |
1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
|
C |
水果电池的电压与哪些因素有关? |
只跟水果的类型有关 |
|
D |
实验中发光二极管不太亮,如何使它更明亮起来? |
可用铜锌作电极,用菠萝作介质并将多个此电池串联起来 |
答案:C
8.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化成氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为 ( )
A.H2+2OH-===2H2O+2e-
B.O2+4H++4e-===2H2O
C.H2-2e-===2H+
D.O2+2H2O+4e-= ==4OH-
==4OH-
答案:C
7.关于如图所示的原电池,下列说法正确的是 ( )

A.电子从锌电极通过电流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应为2 H++2e-===H2↑
H++2e-===H2↑
答案:A
6.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是 ( )
A.两极材料都用石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极的反应式为Cl2+2e-===2Cl-
答案:B
5.分析如图所示的四个原电池装置,其中结论正确的是 ( )
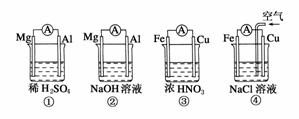
A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-===H2↑
解析:Mg比Al活泼,在①中Mg做负极,但在NaOH溶液中,Mg不反应,而Al可以反应,故②中Al是负极。在浓HNO3中铁会钝化,故Cu为负极,Fe为正极。在④中由于不断向Cu极附近通入空气,而O2比溶液中的H+得e-能力强,故Fe失去的电子,在Cu极被O2得到。电极反应式为:O2+2H2O+4e-===4OH-。
答案:B
4.碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾 溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,下列说法错误的是 ( )
溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2+2H2O+2e-=2MnOOH+2OH-[来源:学,科,网Z,X,X,K]
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g
答案:C
3.(2009·潮阳模拟)利用生活中常见的材料可以进行很 多科学实验,甚至制作出一些有实际应用价值的装置来,如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是 ( )
多科学实验,甚至制作出一些有实际应用价值的装置来,如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是 ( )
A.铝罐将逐渐被腐蚀
B.碳棒上发生的反应为:O2+4e-===2O2-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒的质量会减轻
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com