
思考:平面上的一个圆把平面上的点分成哪几部分?
21.(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

①B中Sn极的电极反应式为__________________,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)__________。
②C中总反应离子方程式为__________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
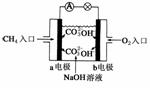
①电池的负极是__________(填“a”或“b”),该极的电极反应是:__________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”、“减小”或“不变”)。
答案:(1)①2H++2e-===H2↑ 增大
②Zn+2H+===Zn2++H2↑ B>A>C
(2)①a
CH4+10OH--8e-===CO+7H2O
②减小
20.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

(1)写出一个能证明还原性Fe比Cu强的离子方程式__________________________,该反应在上图步骤________中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。

(2)分别写出上图步骤②、③相关反应的化学方程式:
步骤②___________________________________________________________________。
步骤③___________________________________________________________________。
(3)上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式________________________________________________________
________________________________________________________________________。
[答案] (1)Fe+Cu2+===Fe2++Cu①
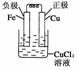
(2)Fe+2HCl===FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
(3)粗铜,Cu-2e-===Cu2+
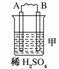
19.由A、B、C、D四种金属按下表中装置图进行实验。
|
装置 |
 |
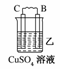 |
 |
|
现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________。
(2)装置乙中正极的电极反应式是________。
(3)装置丙中溶液的pH________(填“变大”或“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是________。
解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,活泼性A>B;乙中C增重,即析出Cu,则B为负极,活泼性B>C;丙中A上有气体即H2产生,则A为正极,活泼性D>A,随着H+的消耗,pH变大。
答案:(1)A-2e-=A2+ (2)Cu2++2e-=Cu (3)变大 (4)D>A>B>C
18.(2009·山东)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是__________。电池工作时,电子流向__________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________。若电解电路中通过2
mol电子,MnO2的理论产量为__ ________g。
________g。
解析:干电池锌(皮)作负极,炭棒作正极,若电解质溶液中混有Cu2+则会形成Zn-Cu原电池而加快锌的腐蚀,在(3)中阳极:Mn2+-2e-+2H2O===MnO2+4H+电路中通过2 mol e-时,生成MnO21 mol(87g)。
答案:(1)Zn(或锌) 正极
(2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 b
(3)2H++2e-===H2↑ 87
17.(2009·江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是 ( )
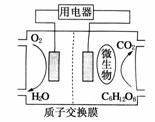
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-===6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气 ,理论上能生成
,理论上能生成 标准状况下CO2气体L
标准状况下CO2气体L
解析:A选项:温度过高,不利于微生物的生存;C选项中,原电池工作时,电解质溶液中的阳离子(H+)应从负极向正极做定向运动;D选项中,原电池工作的总反应为:C6H12O6+6O2===6CO2+6H2O,所以每消耗1 mol O2,就能生成1 mol CO2气体。
答案:B
16.(2009·郑州)获得“863”计划和中科院“百人计划” 支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,相关论文发表在J.Am.Chem.Soc.(128,8720-8721,2006)上,已知电池总反应式为2Al+3I2===2AlI3。下列说法不正确的是 ( )
A.该电池负极的电极反应为:Al-3e-===Al3+
B.电池工作时,溶液中铝离子向正极移动
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多
D.该电池可能是一种可充电的二次电池
解析:A项,根据电池总反应式,推知该原电池中铝作负极,电极反应式为Al-3e-===Al3+;B项,电池工作时,Al3+向正极移动;C项,Li的摩尔质量比Al小,因此Li比等质量Al提供电子的物质的量多;D项,充电时为电解池,在水溶液中Al3+不可能得电子生成Al,因此该电池不是可充电的二次电池。
答案:D
15.(2009·浙江金华一模)现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑
判断它们的还原性由强到弱的顺序是 ( )
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
解析:根据①可知还原性:M>N,根据③可知还原性:N>E,而P能与冷水直接反应,故P的还原性最强,由此可得还原性:P>M>N>E。
答案:B
14.(2009·广东)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-
B.以 NaOH溶液为电解液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
NaOH溶液为电解液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
解析:该电池以NaCl溶液为电解液时,正极反应为O2+2H2O+4e-===4OH-,负极反应为Al-3e-===Al3+,Al3+与OH-进一步反应生成Al(OH)3;以NaOH溶液为电解液时,正极反应为O2+2H2O+4e-===4OH-,负极反应为Al+4OH--3e-===AlO+2H2O,电池工作中溶液pH减小。
答案:A
13.(2009·山东省烟台 市高三模块检测)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
市高三模块检测)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:A g++e-=Ag
g++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③
C.②④ D.③④
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com