
6、 某人从1998年起,每年7月1日到银行新存入a元一年定期,若年利率r保持不变,且每年到期存款自动转为新的一年定期,到2005年7月1日,将所有的存款及利息全部取回,他可取回的总金额是 元。
5、 一个球从100m高处落下,每次着地后又跳回原来高度的一半,再落下,当它第10次着地时,共经过了 m。(精确到1m)
4、 一种设备的价格为450000元,假设维护费第一年为1000元,以后每年增加1000元,当此设备的平均费用为最小时为最佳更新年限,那么此设备的最佳更新年限为 。
3、 农民收入由工资性收入和其它收入两部分构成。2003年某地区农民人均收入为3150元(其中工资性收入为1800元,其它收入为1350元), 预计该地区自2004年起的5 年内,农民的工资性收入将以每年6%的年增长率增长,其它收入每年增加160元。根据以上数据,2008年该地区农民人均收入介于
A.4200元~4400元 B.4400元~4600元 C.4600元~4800元 D.4800元~5000元
2、(2000全国卷)《中华人民共和国个人所得税法》规定,公民全月工资、薪金所得不超过800元的部分不必纳税,超过800元的部分为全月应纳税所得额,此项税款按下表分别累进计算.
|
全月应纳税所得额 |
税率 |
|
不超过500元的部分 |
5% |
|
超过500元至2000元的部分 |
10% |
|
超过2000元至5000元的部分 |
15% |
|
… |
… |
某人一月份应交纳此项税款26.78元,则他的当月工资、薪金所得介于
(A)800-900元 (B)900-1200元 (C)1200-1500元 (D)1500-2800元
1. 某商品降价10%,欲恢复原价,应提价
A.10%
B.9%
C.11%
D.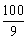 %
%
6.化学反应条件的优化-工业制备硫酸
工业制备硫酸的过程中,关键是怎样把SO2尽可能快尽可能多地转化为SO3。
2SO2(g) + O2(g)  2SO3(g) ΔH = -196.6kJ·mol-1
2SO3(g) ΔH = -196.6kJ·mol-1
⑴温度:400-500℃。从速率分析温度越高越好;从平衡分析温度越低越好。因此综合分析同时考虑到催化剂的活性,选择温度在400-500℃左右。
⑵压强:常压。从速率和平衡分析,压强越大,对生成SO3越有利。但压强越大,对设备的强度要求越高。同时,考虑到常压下SO2转化SO3的产率已可达到90%多,因此没有必要再加压。
⑶催化剂:V2O5 。由于该反应即使在较高的温度下,也难于进行。因此为了提高单位时间SO3的产量,目前工业上采用V2O5作催化剂。
⑷浓度:适当增大SO2特别是O2(即空气)浓度。适当增大SO2和O2浓度,有利于反应向生成SO3的方向移动。(注意:合成SO3过程中,不需要分离出SO3。这是由于在合成SO3过程中,SO2已基本转化为SO3,达平衡后SO2剩余量少。)
⑸投料比:过量空气。生产中使廉价易得的原料(空气)过量,可提高另一原料(SO2)的利用率,从而降低生产成本。因此,在二氧化硫的氧化过程中要通过量空气。
5.测定化学反应速率的物理方法(只作了解):
测定化学反应速率的关键是测定某一时间间隔内反应体系中某物质浓度的变化。
⑴量气法:通过测量反应产物中的气体在一定温度、压强下的体积变化,进而计算化学反应速率的方法。
⑵比色法:根据物质对特定波长的光的吸收性能不同,通过吸光度来测定反应物浓度,并据此来计算化学反应速率的方法。
⑶电导法:根据离子导电能力的差异,通过导电率的变化测定反应物中离子浓度变化,进而计算化学反应速率的方法。
4.化学反应速率的简单计算:
例1、在4种不同的条件下测得反应2SO2 + O2  2SO3的反应速率如下表所示
2SO3的反应速率如下表所示
|
|
(1) |
(2) |
(3) |
(4) |
|
反应速率(mol·L-1·min-1) |
V(SO2) |
V(O2) |
V(SO3) |
V(O2) |
|
0.4 |
0.25 |
0.5 |
0.3 |
则在4种不同条件下的反应速率从大到小的排列顺序为 (填序号)
解析:
方法1: 将用不同物质表示的反应速率转化为用同一种物质表示的反应速率再进行比较。
第⑴种情况下V(O2)= 1/2V(SO2)=1/2 ×0.4mol·L-1·min-1 = 0.2 mol·L-1·min-1
第⑶种情况下V(O2)= 1/2V(SO3)=1/2 ×0.5mol·L-1·min-1 = 0.25 mol·L-1·min-1
所以4种情况的反应速率大小为(4)>(3)=(2)>(1)
方法2:通过比较各物质的反应速率和方程式中该物质的计量系数之比值的大小来比较。
第⑴种情况下:V(SO2)/ 2 = 0.2 第⑵种情况下: V(O2)/ 1 = 0.25
第⑶种情况下:V(SO3)/ 2 = 0.25 第⑷种情况下: V(O2)/ 1 = 0.3
所以4种情况的反应速率大小为(4)>(3)=(2)>(1)
例2、一定条件下在2L的密闭容器中发生反应:2SO2 + O2  2SO3 ,起始时SO2 和O2的物质的量分别为2mol和3mol。反应进行到2分钟的时候,测得SO3的物质的量为1.6 mol,请分别用SO2 、O2和SO3的浓度变化来表示该反应的速率。
2SO3 ,起始时SO2 和O2的物质的量分别为2mol和3mol。反应进行到2分钟的时候,测得SO3的物质的量为1.6 mol,请分别用SO2 、O2和SO3的浓度变化来表示该反应的速率。
解:设反应过程中的SO3的浓度变化为2X 则
2SO2 +
O2  2SO3
2SO3
起始浓度(mol·L-1) 1 1.5 0
变化浓度(mol·L-1) 2X X 2X
2分钟后浓度(mol·L-1) 1-2X 1.5-X 2X
∴ 2X = C(SO3)= 1.6 mol /2L=0.8 mol·L-1 X =0.4 mol·L-1
V(SO3)=△C(SO3)/△t = 0.8 mol·L-1 /2 min = 0.4 mol·L-1·min-1
V(SO2)= V(SO3)= 0.4 mol·L-1·min-1
V(O2)= 1/2V(SO2)= 0.2 mol·L-1·min-1
3.影响化学反应速率的因素:
(1)内因:参加反应的物质的本身性质是影响化学反应速率的决定因素。不同的反应,由于反应物质的结构不同和反应机理不同,因此反应速率不同。
(2)外因:同一反应在不同条件下,反应的速率不同,浓度、温度、催化剂等外界条件对化学反应的速率有影响。
①浓度的影响:当其它条件不变时,增大反应物的浓度,使单位体积内分子数增多,因此可加快反应的速率。例:硫粉在氧气中燃烧比在空气中燃烧激烈。
②压强的影响:当其它条件不变时,加压(缩小体积)对有气体参加的反应,正逆反应速率均加快,气体体积缩小方向的反应速率增加的倍数大于气体体积增大方向增加的倍数;降压(增大体积),正逆反应速率均减小,气体体积缩小方向的反应速率减小的倍数大于气体体积增大方向减小的倍数。注意:改变压强对反应速率产生影响的根本原因是引起反应体系中各物质浓度的改变,若容器恒温、恒容充入稀有气体或其它不反应气体,虽然改变了容器内气体压强,但由于没有改变反应物质的浓度,所以不影响化学反应速率。
③温度的影响:其它条件不变时,升高温度,反应物的能量增加,使原来一部分能量较低的分子变成活化分子,所以可以加快反应的速率。通常情况下,温度每升高10度,化学反应的速率增大到原来的2至4倍。升高温度,对可逆反应,正逆反应速率均加快,但吸热反应增加的倍数大于放热反应增加的倍数;降低温度,正逆反应速率均减小,吸热反应减小的倍数大于放热反应减小的倍数。例:相同大小的铁片和不同温度相同浓度的盐酸反应,温度高者反应速率快。
④反应物间的接触面积的影响:其他条件不变,增大反应物间的接触面积,由于增大了反应物间的接触机会,因此能增大反应的速率。例:相同质量块状碳酸钙和粉末状碳酸钙分别和同体积同浓度的盐酸反应,粉末状碳酸钙反应激烈,放出气体的速率快。
⑤催化剂的影响:其他条件不变的时,使用催化剂能降低反应的活化能,使更多的反应物分子成为活化分子,因此使用催化剂能同时同倍改变正逆反应的速率。
例:H2O2分别在MnO2 、FeCl3、过氧化氢酶等催化作用下的分解,要比没有加催化剂时快得多。
⑥其他因素:除了上述因素外,压强、光波、电磁波、超声波、溶剂等因素对化学反的速率也有影响。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com