
2、某学生称量CuSO4·5H2O时,左盘放砝码4 g,游码在0.5刻度处,天平平衡。右盘CuSO4·5H2O晶体的质量是 ( )
A.4.5 g B.4 g C.3.5 g D.3 g
1、下列关于CuSO4·5H2O的说法错误的是( )
A CuSO4·5H2O为纯净物 B CuSO4·5H2O为混合物
C CuSO4·5H2O变为CuSO4是化学变化
D CuSO4放在空气中变为CuSO4·5H2O是化学变化
4、实验室要测量硫酸铜晶体CuSO4·xH2O中结晶水的值(x):
(1)测量原理是______________________________。要测量的值为_________、________两个量。
(2)①测量中需要的仪器为下列中的________________________________________。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚
H.干燥器 I.石棉网 J.三脚架
②除上述仪器外,还需要的仪器是____________________________________(写出名称)。
③加热前应将晶体放在__________中研碎,加热是放在__________中进行,加热失水后,
应放在__________中冷却。
(3)测量有如下步骤:
①计算:根据实验测得的结果计算硫酸铜晶体中结晶水的物质的量。
②再称:取蓝色晶体后再称量瓷坩埚+硫酸铜晶体的质量(m2)。
③再称:在干燥器内冷却后,称量瓷坩埚+硫酸铜粉末的质量(m3)。
④研磨:在研钵中将硫酸铜晶体研碎。
⑤加热:加热至蓝色晶体全部变为白色粉末,并放入干燥器中冷却。
⑥再加热:把盛有硫酸铜的瓷坩埚再加热,再冷却。
⑦再称重:将冷却后的盛有硫酸铜的瓷坩埚再次称量(两次称量误差不得超过0.001 g)。
⑧称量:准确称量一干燥洁净的瓷坩锅质量(m1)。
正确的操作顺序为_______________________________________________(排列编号)
(4)数据记录和处理:
某学生测定硫酸铜晶体CuSO4·xH2O结晶水含量记录了如下数值,试通过计算完成下列表格:
|
|
第一次实验 |
第二次实验 |
|
坩埚质量(g) |
14.520 |
14.670 |
|
坩埚质量+晶体质量(g) |
17.020 |
18.35 |
|
坩埚质量+无水硫酸铜质量(g) |
16.070 |
17.004 |
|
晶体的净质量(g) |
|
|
|
无水硫酸铜质量(g) |
|
|
|
水的质量(g) |
|
|
|
计算出x的值(保留两位小数) |
|
|
|
X的两次实验平均值 |
|
硫酸铜晶体中x的理论值为_____________,本实验的相对误差为________________。
(5)误差分析:计算x值的公式为_________________________________,分析下列操作对于实验结果有何影响?为什么?
①加热前称量时容器未完全干燥________________________________________
②最后两次加热后的质量相差较大______________________________________
③加热后容器未放入干燥器中冷却______________________________________
④加热过程中有少量溅失______________________________________________
⑤加热前晶体表面有水________________________________________________
⑥晶体不纯,含不挥发性的物质________________________________________
⑦坩埚内含有不挥发性的物质__________________________________________
⑧晶体未研成粉末,加热后还有少量颗粒________________________________
⑨晶体未完全变白,就停止加热________________________________________
⑩加热时间太长,部分变黑____________________________________________
(6)问题与讨论:
①实验中要做到:加热要充分但不“过头”的原因是________________________________ 。
②实验中要放在干燥器中冷却的原因是___________________________________________。
③实验中判断是否完全失水的方法是______________________________________________。
④实验中(包括两次平行实验)共计至少要加热________________次,称量___________次。
3、结晶水合物性质不稳定,在加热或者放在空气中会失去部分或全部的结晶水:
写出将CuSO4·xH2O加热分解的方程式:________________________________,
反应现象为___________________________________。
2、硫酸铜晶体的化学式(CuSO4·xH2O),则晶体中的水与硫酸铜的物质的量之比为__________,晶体中结晶水的质量百分含量为__________________;将m1g晶体受热分解,完全失去结晶水后剩余固体质量为m2g,则硫酸铜粉末的物质的量为______________mol,加热过程中失去水的物质的量为__________mol,晶体中的H2O与CuSO4的物质的量之比表示为_________________。
1、请写出下列物质的化学式:
胆矾:_____________,明矾:_____________,绿矾:___________,生石膏:_________。
石碱:_____________,纯碱:_____________,烧碱:____________,小苏打:________。
23.将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少?(8分)
22.实验室制取氧气时,取一定量的氯酸钾和二氧化锰的混合物加热:
2KClO3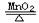 2KCl+3O2↑
2KCl+3O2↑
开始时二氧化锰含量为26.5﹪,当二氧化锰的含量为30﹪时,求氯酸钾的分解率是多少?(7分)
21.由A和B两种盐组成的混合物,进行了下列实验:(6分)
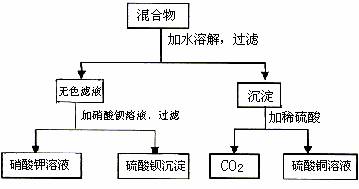
试判断,A、B分别是 。
写出实验过程中加水时时发生反应的离子方程式 。
20.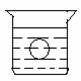 如图所示,在一烧杯中盛有H2SO4溶液,
如图所示,在一烧杯中盛有H2SO4溶液, 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。(4分)
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。(4分)
试回答
 ⑴此实验中,观察到的现象有
⑴此实验中,观察到的现象有
① ,
② 。
⑵写出实验过程中反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com