
12.下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间
后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是()
 A.产生气体体积 ①=②
A.产生气体体积 ①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑
②中负极:2H++2e-=H2↑
D.溶液的pH变化:① 减小,② 增大
[答案]D
11.由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为
A 1.75a% B 1-1.75a% C 1.25a% D 无法计算 [答案]B
10. 0.02mol·L-1的HCN溶液与0.02mol·L-1的NaCN溶液等体积混合,已知混合液中[CN-]<[Na+],则下列关系正确的是( )
A.[Na+]>[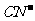 ]>[
]>[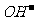 ]>[H+] B.[HCN]+[
]>[H+] B.[HCN]+[
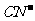 ]=0.04
mol·L-1
C.[Na+]=[
]=0.04
mol·L-1
C.[Na+]=[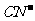 ]+[HCN]
D.[
]+[HCN]
D.[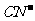 ]>[HCN]
[答案]A
]>[HCN]
[答案]A
9. 用锌、氧化铜、稀硫酸作原料制取铜,有下列两种途径:
(1)
(2)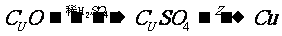
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是[ ]
A. 生成的硫酸锌质量相同 C.消耗相同质量的锌
B. 消耗相同质量的硫酸 D.消耗相同质量的氧化铜
[答案]D
8. 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol,用反应物B浓度的减少来表示该反应的速率可能为( )
A B
B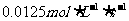
C D
D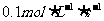 [答案]B
[答案]B
7.某有机物分子由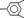 、-CH=CH-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是(
)
、-CH=CH-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是(
)
A 2︰1 B 8︰5 C 3︰2 D 22︰19 [答案]C
6.下列实验中操作、现象、结论对应关系正确的一组是( )
|
选项 |
操作 |
现象 |
结论 |
|
A |
在蔗糖中加入几滴水搅拌均匀,再加入浓硫酸,迅速搅拌 |
蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 |
只体现了浓硫酸的脱水性 |
|
B |
淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 |
产生红色沉淀 |
淀粉水解可生成葡萄糖 |
|
C |
溴乙烷和氢氧化钠溶液充分反应后,用足量稀硝酸酸化,再加入硝酸银溶液 |
生成淡黄色沉淀 |
溴乙烷中含有溴元素 |
|
D |
将溴水加入苯中并充分振荡 |
溴水褪色 |
苯与溴发生了取代反应 |
[答案]C
5. 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体,与白磷分子相似。已知断裂1molN-N键吸收193kJ热量,断裂1mol氮氮叁键吸收941kJ热量,则( )
A.N4的熔点比P4高
B.1molN4气体转化为N2时要吸收748kJ能量
C.N4是N2的同系物
D.1molN4气体转化为N2时要放出724kJ能量 [答案]D
4. 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出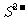 的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是(
)
的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是(
)
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑ [答案]C
3. 在实验室中,下列叙述的保存方法正确的是( )
①白磷保存在冷水中 ②Na保存在CC14中 ③HF溶液保存在塑料瓶中
④AgNO3溶液保存在棕色试剂瓶内 ⑤浓硝酸保存在棕色广口瓶内
A.①③④ B.③④ C.①②③④ D.①②③④⑤ [答案]A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com