
2.下列污染现象主要与NO2有关的是 ( )
A.臭氧空洞 B.水体富营养化 C.光化学烟雾 D.温室效应
SO2、NO2 是大气污染的主要污染物,请解答1-2题
1.下列污染现象主要与SO2有关的是 ( )
A.臭氧空洞 B.酸雨 C.光化学烟雾 D.温室效应
3.胶体的重要性质
①丁达尔现象:光通过胶体时所产生的光亮的通路的现象。胶体的丁达尔现象是由于胶体微粒对光线的散射而形成的,溶液无此现象,故可用此法区别溶液和溶胶。
②布朗运动:胶体粒子所作的无规则的、杂乱无章的运动。布朗运动是分子运动的体现。
③电泳现象:在外加电场的作用下,胶粒在分散剂里向阴极或阳极作定向移动的现象。工业生产中可利用电泳现象来分离提纯物质。
|
胶体微粒 |
吸附的离子 |
胶粒带的电荷 |
在电场中胶粒移动方向 |
|
金属氢氧化物、金属氧化物 |
阳离子 |
正电荷 |
阴极 |
|
非金属氧化物、金属硫化物 |
阴离子 |
负电荷 |
阳极 |
例如:在电泳实验中,Fe(OH)3胶体微粒向阴极移动,使阴极附近颜色加深,呈深红褐色;而As2S3胶体微粒向阳极移动,使阳极附近颜色加深,呈深金黄色。
④胶体的聚沉:一定条件下,使胶体粒子凝结而产生沉淀。胶体聚沉的方法主要有三种:a.加入电解质 b.加入与胶粒带相反电荷的另一种胶体 c.加热。如:制皂工业生产中的盐析,江河入海口三角洲的形成等等。
⑤渗析:依据分散系中分散质粒子的直径大小不同,利用半透膜把溶胶中的离子、分子与胶粒分离开来的方法。利用渗析可提纯胶体。
[例3](2008·湖北仙桃) Fe(OH)3胶体中常混有FeCl3和HCl。试回答有关问题:
(1) 实验室制取Fe(OH)3胶体的方法是______________________________________,用__________方法除去胶体中的浑浊;根据____________现象证明胶体已经制成。
(2) 鉴别溶液中存在Fe3+和H+的方法是_____________________________________
_________________________________________________________________________。
(3) 除去胶体中混有的FeCl3和HCl的方法是____________________________。
(4) 如何用实验方法证明胶体和Cl-两者已经分离?______ _______________ _______________________________________________________。
[解析]向沸水中滴加饱和FeCl3溶液可制得Fe(OH)3胶体;利用过滤法可分离浊液和胶体,利用渗析法可分离浊液和胶体;利用丁达尔效应可以检验胶体的存在。
[答案](1)在沸腾的蒸馏水中滴加饱和FeCl3溶液,待溶液呈红褐色,停止加热,即制得胶体 ;过滤 ;丁达尔现象
(2)滴加KSCN溶液,变红色说明有Fe3+,pH试纸检验,变红,说明有H+
(3)渗析(将胶体装入半透膜中,然后置于蒸馏水中)
(4)取半透膜外最后一次的溶液少许于试管中,加入AgNO3溶液,若无沉淀产生,证明两者已经分离。
2.胶体的分类
 气溶胶--雾、云、烟
气溶胶--雾、云、烟
 按分散剂状态分 液溶胶--Fe(OH)3胶体、蛋白质溶液
按分散剂状态分 液溶胶--Fe(OH)3胶体、蛋白质溶液
胶体 固溶胶--烟水晶、有色玻璃
 按分散质分 粒子胶体-分散质微粒是很多分子或离子的集合体,如Fe(OH)3胶体
按分散质分 粒子胶体-分散质微粒是很多分子或离子的集合体,如Fe(OH)3胶体
分子胶体-分散质微粒是高分子,如淀粉溶液,蛋白质溶液
1.胶体的本质特征:分散质粒子的直径大小在1nm-100nm之间
3.溶质质量分数(a%)
溶质质量分数=
[例2](2008·南昌一模)右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
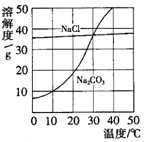 (1)当温度为10℃时,碳酸钠的溶解度为
;
(1)当温度为10℃时,碳酸钠的溶解度为
;
(2)当温度 时,氯化钠的溶解度大于碳酸钠的溶解度;
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。请你解释原因:“夏天晒盐” ;
“冬天捞碱” 。
[解析]由题给中的溶解度曲线易看出,10℃时,碳酸钠的溶解度为10g;30℃时,氯化钠、碳酸钠的溶解度大致相等,当温度高于30℃,氯化钠的溶解度小于碳酸钠的溶解度,当温度低于30℃时,氯化钠溶解度大于碳酸钠的溶解度;且氯化钠的溶解度随温度的变化不大,碳酸钠的溶解度随温度的变化很大,所以加热蒸发浓缩有利于氯化钠晶体的析出,降温冷却则有利于碳酸钠晶体的析出。
[答案](1)10g (2)小于30℃ (3)氯化钠的溶解度受温度影响不大,夏天温度高水分蒸发快,氯化钠易结晶析出;碳酸钠的溶解度受温度影响大,冬天温度低,碳酸钠易结晶析出。
考点三 胶体及其性质
2.气体的溶解度
在一定温度和1.01×105Pa时,1体积溶剂里达到溶解平衡时溶解的气体体积数(要换算成标准状况时的气体体积)。气体溶解度随温度的升高而减小,随压强的增大而增大。
1.固体的溶解度
(1)定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
注意点:①一定温度 ②100g溶剂 ③达到溶解平衡状态(饱和状态)④单位是克(g)
(2)有关关系式:S(溶解度)=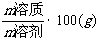
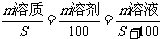
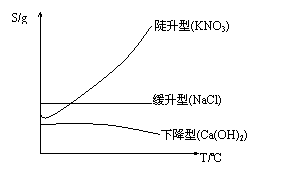 (3)溶解度曲线:
(3)溶解度曲线:
溶解度曲线是溶解度随温度变化的一种
表示方法。溶解度曲线可表示:
①同一物质在不同温度时的不同溶解度;
②不同物质在同一温度时不同溶解度;
③物质溶解度受温度变化影响的大小;
④比较不同物质的溶解度的大小。
4.溶解平衡
在一定条件下,溶解速率等于结晶速率的状态叫溶解平衡。溶解平衡是动态平衡,溶解和结晶仍在进行。达到溶解平衡的溶液是饱和溶液,它的浓度一定,未达到溶解平衡的溶液是不饱和溶液,通过加入溶质、蒸发溶剂、改变温度等方法可使不饱和溶液成为饱和溶液。
未溶解的固体溶质 溶液中的溶质
溶液中的溶质
[例1](2008·眉山市)向200C的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
A.溶液温度末冷却到200C时,溶液一定是饱和溶液
B.溶液温度末冷却到200C时,溶质质量分数比甲溶液大
C.溶液温度恢复到200C时,溶液质量比甲溶液小
D.溶液温度恢复到200C时,溶液的溶质质量分数和甲溶液的相等
[解析]Ca(OH)2的溶解度随着温度的升高而降低。向200C的饱和澄清石灰水中投入适量的氧化钙粉末,加入的CaO会与水反应生成Ca(OH)2,不仅消耗了溶剂水,并且反应会放出大量的热,使溶液的温度升高,所以当溶液的温度等于200C时,肯定会有溶质Ca(OH)2析出,所得的溶液仍为饱和溶液,溶质的质量分数不变。
[答案]B
考点二 溶解度、溶质的质量分数
3.溶解过程:溶质分散到溶剂里形成溶液的过程叫溶解。物质溶解时,同时发生两个过程:

溶解是一个物理、化学过程,并伴随着能量变化,溶解时溶液的温度是升高还是降低,取决于上述两个过程中放出和吸收热量的相对大小。如:浓硫酸稀释溶液温度升高,NH4NO3溶于水溶液温度降低。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com