
2、理解阿伏加德罗定律和以下的推论
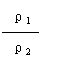 ①同T、P时,
①同T、P时,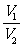 =
= 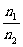 =
=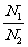 ;②同T、P时, =
;②同T、P时, =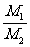 ;
;
③同T、V时,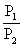 =
=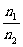 ;
④同T、P、V时,
;
④同T、P、V时,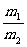 =
=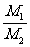 ;
;
⑤同T、P、m时,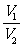 =
=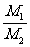 。
。
试题枚举
[例1](2004江苏)阿佛加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.标准状况下,2.24L苯中约含有3.612×1023 碳原子
B.常温常压下,氧气和臭氧的混和物16g中约含有6.02×1023 个原子
C. 25℃时,1LpH=13的氢氧化钠溶液中约含6.02×1023个氢氧根离子
D.0.5molCH4中约含有3.01×1024 个电子
解析:由于苯为液体,无法知道2.24L苯物质的量,所以A不正确。25℃时1LpH=13的氢氧化钠溶液中含氢气氧根的物质的量0.1mol即6.02×1022 即C不正确。B中16gO2与O3混和 物即含1mol氧原子。D中由于1molCH4含10mol电子,所以0.5mol中含电子数0.5×6.02×1023=3.01×1024个
答案:B、D
[例2]下列说法正确的是( )
A.1mol任何物质在标准状况下的体积都约是22.4L
B.0.5 mol氢气的体积为11.2L
C.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L
D.在20L恒容密闭容器中,充入1mol的氮气和3mol氢气,达平衡后有0.5mol的氮气反应,平衡后混合气体的体积仍为20L
解析:A.不正确,只有1mol气体在标准状况下的体积都约是22.4L,不能说任何物质。
B.不正确,因为没有指明标准状况。
C.不正确,因为三氧化硫在标准状况下不是气体。
D.正确,因为不论在任何条件下,气体都将充满整个容器。
答案:D
[例3]若以w1和w2分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A.2w1= w2 B.2 w2= w1 C.w2>2 w1 D.w1>w2>2 w1
解析:对于氨水来讲,浓度越大,密度反而越小。然后利用质量分数和物质的量浓度的转换关系,进行判断。
答案:C
[例4]假设12C相对原子质量为24,如果以0.024kg12C所含的原子数为阿伏加德罗常数,下列数值肯定不变的是
A.气体摩尔体积常数(标准状况)
B.标准状况下16g O2所占体积
C.O2的相对分子量
D.一定条件下,跟2gH2相化合的O2的物质的量
解析:以0.024kg12C所含的原子数为阿伏加德罗常数,则阿伏加德罗常数变为原来的2倍,即1mol气体的含的分子数为原来的2倍,A项变化了。B项明确了气体的温度、压强和质量,体积一定,不随原子量标准及阿伏加德罗常数的改变而改变。对于C项,由于12C相对原子质量变为原来的2倍,则任何元素的相对原子质量均变为原来的2倍,各种分子相对分子质量也将扩大为原来的2倍,即此时的O2相对分子质量变为64,对于D项,与2gH2相化合的O2的质量是不变的,因为O2的摩尔质量改变,故O2的物质的量也发生改变。
答案:B
[例5]设N表示阿伏加德罗常数,则下列说法正确的是:
A.标准状况下,以任意比例混合的甲烷和丙烷混合气体22.4L,所含的气体的分子数约为N个
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5N个
C.常温下,2.3g金属钠变成钠离子时,失去的电子数目为0.1N个
D.常温下,18g重水所含中子数为10N个
解析:A.正确,任意比例混合的甲烷和丙烷混合气体 22.4L,气体的总物质的量为1mol,因此含有N个分子。
B.不正确,因为NO和氧气一接触就会立即反应生成二氧化氮。
C.正确,2.3g钠是0.1mol钠原子,钠原子变成离子的反应为:Na-e=Na+
1、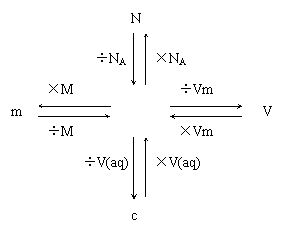
|
n |
3、通过基本计算问题的讨论,培养学生的计算思维能力。
知识梳理
2、掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状态下)之间的相互关系。
1、掌握物质的量及其单位--摩尔、摩尔质量、气体摩尔体积的涵义。
20、“不粘锅”的内层其实是在金属的内壁涂了一层聚四氟乙烯,故而不粘食物。以下对聚四氟乙烯的叙述错误的是:
A、它在没有水加热时容易燃烧 B、其中的C-F键非常稳定
C、它的单体含有C=C双键 D、分子内支链多且互相缠绕
19、在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:3A(g)
 + B(g) nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
+ B(g) nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
A、1 B、2 C、3 D、4
18、燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质溶液是强碱。下面关于甲烷燃料电池的说法正确的是
A、负极反应为:O2+2H2O+4e →4OH-; B、负极反应为:CH4+10OH- - 8e→CO32-+7H2O
C、放电时溶液中的阴离子向负极移动; D、随放电的进行,溶液的pH值不变

17、下列各组离子,在指定环境中一定能大量共存的是
A、pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B、加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3-
C、能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42-
D、由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl-
15、制印刷电路时常用氯化铁作腐蚀液,有关反应为2FeCl3 + Cu =2FeCl2 + CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中不可能出现的是
A、有铜无铁; B、有铁无铜 C、铁、铜都有 D、铁、铜都无
|
|
|
|



 A、 ×100% B、 % C、 % D、
%
A、 ×100% B、 % C、 % D、
%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com