
8.[江苏省前黄高级中学国际分校09届第一学期期末综合练习二]二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃ - 140℃与硫反应,即可得S2C12粗品。
②有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
|
S |
112.8 |
444.6 |
略 |
|
S2C12 |
-77 |
137 |
遇水生成HCl、SO2、S;300℃以上完全分解; S2C12 + C12  2SCl2 2SCl2 |
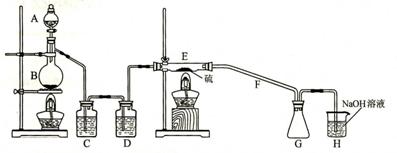 设计实验装置图如下:
设计实验装置图如下:
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见___________ ___ ___。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:_________________________________________________;
E中反应的化学方程式:_________________________________________________。
(3)C、D中的试剂分别是__________________________、_______________________。
(4)仪器A、B的名称分别是____________、____________,F的作用是___________。
(5)如果在加热E时温度过高,对实验结果的影响是_____________________________,
在F中可能出现的现象是________________________________________________。
(6)S2C12粗品中可能混有的杂质是(填写两种)______________、________________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________。
答案..(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗)
在G和H之间增加干燥装置
(2)MnO2 + 4 H+ +2 C1- == Mn2+ + C12 ↑+ 2H2O
2 S + C12
 S2C12
S2C12
(3)饱和食盐水(或水) 浓硫酸
(4)分液漏斗 蒸馏烧瓶 导气、冷凝
(5)产率降低 有固体产生(或其他正确描述)
(6)SCl2、C12、S(任写其中两种即可) 控制浓盐酸的滴速不要过快
214.5g÷143g/mol-0.875mol n2(HCl)
=0.625mol
n2(HCl) =1.25mol
反应后溶液中n(HCl)=0.5L×12mol/L-3.5mol-1.25mol=1.25mol
c(HCl)=1.25mol÷0.5L=2.5mol/L(2分)
⑶ 2.5mol/L(2分) 不变(2分)
7.[江苏省前中国际分校2009届高三第一学期第一次调研试卷](8分)一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。
(1)从原子经济学角度出发,要使浓盐酸中Cl-充分转化为Cl2,制取等量的Cl2最好选用上述氧化剂中的 氧化浓盐酸。
(2)将214.5gCa(ClO)2放入500 mL 、12.0 mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
(3)漂白粉是 Ca(ClO)2、CaCl2 ·Ca(OH)2 ·H2O 和 CaO 的混合物。漂白粉放出的氯气具有漂白作用,叫有效氯。通常用有效氯表示漂白粉的纯度。漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI ,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定。若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度最好小于 mol/L,测定的有效氯将 (“偏高”、“偏低”或“不变”)。
答案.⑴ KClO3或Ca(ClO)2(2分)
⑵ 解:Ca(ClO)2 + 4HCl=CaCl2 + 2Cl2↑+2H2O
1 4 2
n(Ca(ClO)2) n1(HCl) 39.2L÷22.4L/mol=1.75mol
n(Ca(ClO)2)=0.875mol n1(HCl)=3.5mol
Ca(ClO)2 + 2HCl=CaCl2 + 2HClO
1 2
6. [ 江苏省泗阳致远中学2009届高三化学综合模拟试卷二]已知在酸性条件下有以下反应关系:
①KBrO3能将I-氧化成KIO3,本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。
向KBrO3溶液中滴加少量KI的硫酸溶液后,所得产物除水外还有
A.Br-、I2 B.Br2、Br-、I2 C.Br2、I2、IO3- D.Br2、IO3-
5.[常州国际学校09届高三化学综合测试 ]取相同体积的KI、Na2S和FeBr2溶液分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温同压下),则KI、Na2S、FeBr2溶液的物质的量浓度之比为[ C] w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
A.1︰1︰2 B.2︰1︰3 C.6︰3︰2 D.3︰2︰1
 ①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。请回答:
(1)反应后所得的溶液漂白性增强的原因是 。
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有 。
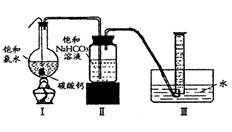 实验二、定量研究:
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳
酸钙和150mL饱和氯水,按如图所示装置实验,待不
再产生气泡后,将塑料网中剩余的石灰石提出液面,
密封后再加热、煮沸烧瓶中的液体,直到量筒中的气
体不再增加(不考虑HClO的分解)。请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造
成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现B/22.4 moL明显小于A/100 moL。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是 。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是 。
4.(1)CaCO3 消耗了氯水中的 HCl, 使 Cl2+H2O HCl+HClO 平衡向右移动 , HClO 浓度增大(2分)
HCl+HClO 平衡向右移动 , HClO 浓度增大(2分)
(2)Ca(HCO3)2( 写名称正确同样得分 ) (2分)
(3)在导管末端再连接长导管 , 使导管的出口接近量筒底部(2分)
(4)碳酸钙与氯水反应生成的Ca(HCO3)2再受热时,除生成CO2外,还生成了CaCO3(3分)
(5)从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集(3分)
0.150mol/0.300L = 0.500 mol•L-1
2.24L(标态) 13.8g 2.24L(标态) 10.0g
∵ 13.8g>11.9g>10.0g
∴ 得到的白色固体是 K2CO3和KHCO3的混合物。
设白色固体中 K2CO3 x mol,KHCO3 y mol,即
①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3
x mol 2x mol x mol y mol y mol y mol
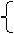 x mol+y mol=2.24L/22.4mol•L-1=0.100 mol (CO2)
x mol+y mol=2.24L/22.4mol•L-1=0.100 mol (CO2)
138g•mol-1 × x mol 100 g•mol-1 × y mol=11.9g (白色固体)
解此方程组,得
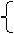 x=0.0500mol (K2CO3)
x=0.0500mol (K2CO3)
y=0.0500mol (KHCO3)
∴ 白色固体中 ,K2CO3 质量为 138g•mol-1 × 0.0500mol=6.90g
KHCO3质量为 100 g•mol-1 ×0.0500mol=5.00g
消耗 KOH 物质的量为
2x mol+y mol=2×0.0500mol+0.0500mol=0.150mol
∴所用 KOH 溶液物质的量浓度为
22.4L(标态) 138g 22.4L(标态) 100g
0.1mol钠原子就失去0.1mol电子,也就是0.1NA个电子。
D.不正确,重水分子(D2O)中含有10个中子,分子量为 20,18g重水所含中子
数为:10×18g/20g· mol-1=9mol。
答案:AC
[例6]在25℃、100kPa条件下,将15L O2通往10LCO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1) 若剩余气体的体积是15L,则原CO和H2的混合气中:V(CO)=______L,V(H2)____L.
(2) 若剩余气体的体积为aL,则原CO和H2的混合气中V(CO): V(H2)=_____________。
(3) 若剩余气体的体积为aL,则a的取值范围是____________________.
解析:本题以H2 、CO燃烧反应为载体考查化学计算能力及由具体到一般的科研能力,审题关键:①2CO+ O=2CO2,2 H2+ O2=2 H2 O,反应物之间化学计量数比相同,推知完全燃烧,耗O2体积是H2 、CO混气体积1/2。②H2 、CO之间比值与O2剩余无关,一定剩余10L。③剩余气体混合物经干燥,一定不含H2 O,混合气成分为CO2、O2。
(用守恒法和极限法求解):由化学方程式2CO+ O=2CO2,2 H2+ O2=2 H2 O(液)知,10LH2 、CO混合气(无论其体积比如何)消耗的O2体积恒为5L。剩余的气体为O2(10L)和CO2的混合气,且由碳原子数目守恒知V(CO2)=V(CO)
(1)剩余气体15L,其中O2为10L,则V(CO2)=5L,V(H2)=10L-V(CO2)=5L,V(CO2)=V(CO)=5L。
(2)剩余气体为aL,则其中CO2为V(CO2)=aL-10L,V(CO)= V(CO2)=(a-10)L,V(H2)=10L-V(CO)=10L-(a-10)L=20L-Al,V(CO)/V(H2)=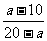
(3)因剩余气体中一定有10L O2,故a>10。设10L原气体全是CO,则最多有10L CO2,故a <20。A的取值范围是10<a<20
答案:(1)5L 5L (2)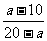 (3)10<a<20
(3)10<a<20
[例7]Cu、Cu2O和CuO组成的混合物,加入100Ml0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。求:
(1) 写出Cu2O跟稀硝酸反应的离子方程式。
(2) 产物中硝酸铜的物质的量。
(3) 如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别为多少?
(4) 如混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围。
解析:本题为混合物的计算,若建立方程组求解,则解题过程较为繁琐。若抓住反应的始态和终态利用守恒关系进行求解,则可达到化繁为简的目的。
(1) 利用电子守恒进行配平。3Cu2O+14HNO3==6Cu(NO3)2 + 2NO↑+7H2O
(2) 利用N原子守恒。n(HNO3)== 0.06mol,n(NO)== 0.01mol,
则n(Cu(NO3)2)==(0.06-0.01)/2=0.025mol
(3) 本题混合物中虽含有Cu、Cu2O和CuO三种物质,但参加氧化还原反应的只有 Cu、Cu2O,所以:
转移电子总数:n(e-)= n(NO)×3==0.03mol
Cu提供电子数:0.01×2=0.02mol
Cu2O提供电子数:0.03-0.02=0.01mol n(Cu2O)=0.01/2=0.005mol
n(CuO)=0.0025-0.01-0.005×2=0.005mol
(4) 根据(3)解法可得n(Cu2O)=0.015-Xmol n(CuO)=X-0.005mol。根据电子守恒进行极端假设:若电子全由Cu提供则n(Cu)=0.015mol;若电子全由Cu2O提供则n(Cu2O)=0.015mol,则n(Cu2+)==0.03mol大于了0.025mol,说明n(Cu)不等于0,另根据n(CuO)=X-0.005mol要大于0可得n(Cu)>0.005mol。所以0.005mol < n(Cu)<0.015mol。
[例8]向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少
解析:(1)由于CO2和KOH反应时物质的量之比不同则产物不同,故可根据CO2和KOH反应时物质的量之比对产物进行讨论。由:①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3可知n(CO2)/n(KOH)=1/2时产物为K2CO3,n(CO2)/n(KOH)=1时产物为KHCO3,所以n(CO2)/n(KOH)<1/2时,KOH 过量则产物为K2CO3+KOH ; 1/2< n(CO2)/n(KOH)<1时,对于①反应来说二氧化碳过量而对于②反应来说二氧化碳量不足,所以产物为K2CO3+KHCO3 ;n(CO2)/n(KOH)>1时,二氧化碳过量,则固体产物为KHCO3。 答案为:①K2CO3+KOH ②K2CO3 ③K2CO3+KHCO3 ④KHCO3
(2)由:①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com