
|
1. 2. |
考点3:铁的氧化物和氢氧化物
[例1] 将nmol木炭粉和1mol氧化亚铁在反应容器中混合隔绝空气加强热,可能发生的化学反应有:① ②
③ ④
(1)若n<1/4,充分反应后,反应器中的固体物质是 ,气体产物是
(2)若n>4,充分反应后,反应器中的固体物质是 ,气体产物是
(3)若反应的气体产物是混合物,n的取值范围是 。
(4)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为
。
[感悟]:
[例2] 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1摩,在此溶液中加入90毫升4摩/升的NaOH溶液,使其充分反应。设Al3+物质的量与总物质的量的比值为x。
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是 ?物质的量有 ?
(2)计算沉淀中只有Fe(OH)3的x取值范围为 。
(3)若Al3+和Fe3+物质的量之和为A摩(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围和各沉淀的物质的量 (用含有A、x的式子表示)。
[感悟]:
2.铁的氢氧化物
|
化学式 |
Fe(OH)2 |
Fe(OH)3 |
|
颜色 状态 |
|
|
|
溶解性 |
|
|
|
稳定性 |
|
|
|
与H+反应 |
|
|
|
转化关系 |
|
[思考]
(a)配制FeSO4溶液时,需加入 和 ,其作用分别 、
。
(b)制取Fe(OH)2时,为什么要用新制的FeSO4溶液?为什么要将吸有NaOH溶液的胶头滴管插入液面以下?
(c)若不用此法,还可用什么方法制得Fe(OH)2沉淀?
(d)烧过菜的铁锅未及时洗干净(残液中含NaCl),第二天便出现红棕色锈斑[Fe(OH)3失水的产物],试用有关的电极反应式和化学方程式表示Fe(OH)3的生成过程。
正极: 、负极:
总反应: .
Fe(OH)2的氧化:
总结:用可溶性碱分别与Fe2+、Fe3+反应可制得Fe(OH)2和Fe(OH)3。通过哪些方法可避免生成Fe(OH)2中会有Fe(OH)3?
提示:关键在于无孔不入的O2及Fe3+存在。4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3↓
①驱氧法:如用同煮沸过的NaOH溶液和亚铁盐溶液。
②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液面下加入;又如在液面上加某些合适的有机溶剂液封。
③还原法:在FeSO4溶液中加入Fe钉,或者用Fe与稀H2SO4反应新制的FeSO4溶液,生成的H2又可驱赶O2。
铁的氧化物和氢氧化物
1.铁的氧化物
|
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
|
俗 称 |
|
|
|
|
颜色状态 |
|
|
|
|
溶解性 |
|
|
|
|
铁的化合价 |
|
|
|
|
与H+反应 |
|
|
|
|
与稀HNO3反应 |
|
|
|
|
与CO或H2反应 |
|
|
|
|
铝热反应 |
|
|
|
[思考]在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成 而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的 气体,它们把该红色物质还原为黑色的化合物 ,同时还有未烧的碳粒而制得了青色砖瓦。
3.重点掌握根据氧化还原的原理进行有关铁及其化合物的相关计算。培养分析、综合、归纳问题的能力和解决问题的能力。
2.掌握铁的氢氧化物的性质和制备。
1.掌握铁的氧化物的性质。
21.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
[问题1]工业生产碘酸钾的流程如下:

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式:_________________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是____________。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
[问题2]已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
I2+2S2O32―=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL
0.1mol/L KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
答案.[问题1](1)6I2 + 11KClO3 + 3H2O = 6KH(IO3)2 + 5KCl + 3Cl2↑;(2)蒸发结晶;
[问题2](1)分液漏斗(多写烧杯、玻璃棒等合理答案不扣分);(2)1270/3w(423.33/w)。
(3)①4I-+4H++O2=2I2+2H2O;②学生乙的实验结果会偏大
20.(江苏海门市2008-2009学年高三第一次教学质量调研)(12分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法海水淡化最理想的能源是 ;
(2)从海水中可得到多种化工原料和产品。下列是利用海水资源的流程图。

① 反应II的离子方程式为 ;
从反应III后的溶液中得到纯净的单质溴的实验操作方法是 。
② 在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ;
③ 电解25%的饱和食盐水200kg,当NaCl浓度下降到20%时,计算收集到氯气的物质的量。(溶于溶液的氯气忽略不计,计算结果保留一位小数)
答案..(12分)(⑴⑵两题每空2分) ⑴太阳能等;
⑵ ① SO2+Br2+2H2O=4H++2Br-+SO42-; 蒸馏(多写萃取不扣分);
② 苦卤样品的体积、Mg(OH)2沉淀的质量;
③ 97.7 mol。 (此小题4分,根据计算过程,酌情给分。)
说明:本试卷中其他合理答案同样给分
19.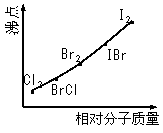 (江苏海州高级中学2009届高三化学第三次综合测试) (8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
(江苏海州高级中学2009届高三化学第三次综合测试) (8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
 ⑴卤素互化物BrCl能发生下列反应
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式_____________ _。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式________________________。
⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________________________________________。
⑶试推测ICl的沸点所处的最小范围_____________________________________________。
答案..(1)①KI+IBr==KBr+I2
②C6H6+ICl→C6H5I+HCl;或
(2)相对分子质量越大,分子间作用力越强
(3)介于Br2的沸点和IBr的沸点之间
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com