
5.可逆反应
在同一条件下,同时向正、逆反应方向进行的反应。
如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑
2H2↑+O2↑
这两个反应条件不同,故不能视为可逆反应。
而2SO2+O2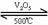 2SO3,SO2+H2O
2SO3,SO2+H2O H2SO
3发生在同一条件下,它们均为可逆反应。
H2SO
3发生在同一条件下,它们均为可逆反应。
4.SO2与Cl2的漂白性比较
两种气体虽都有漂白性,但原理及现象又不同。Cl2是由于溶于水生成的HClO有强氧化性 ,将有色物质氧化成无色物质,褪色后不能恢复到原来颜色--永久漂白,而SO2是由于溶于水生成的H2SO3与有色物质直接结合,形成不稳定的无色化合物,褪色后在一定的条件下又能恢复原来的颜色--暂时漂白。
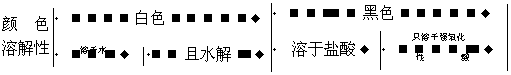
3.金属硫化物的颜色和溶解性
硫化物 K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag
2.硫的氢化物、氧化物及其水化物的结构、性质
|
类别 |
氢化物 |
氧 化 物 |
氧化物水化物 |
|||
|
结 构 |
分子式 |
H2S |
SO2 |
SO2 |
H2SO3 |
H2SO4 |
|
化学键 |
极性键 |
极性键 |
极性键 |
极性键配位 |
极性键配位 |
|
|
晶体类型 |
分子晶体 |
分子晶体 |
分子晶体 |
分子晶体 |
分子晶体 |
|
|
物理性质 |
色、味、态 |
无色有臭鸡蛋气味的气体 |
无色有刺激性气味的气体 |
无色固体 |
无色有刺激性气味的液体 |
无色油状液体 |
|
毒性 |
有毒气体是空气污染物 |
有毒气体,是空气污染物 |
无毒腐蚀性强 |
有毒不稳定 |
无毒,强腐蚀性 |
|
|
化学 性 质 |
与水反应 |
溶于水,不与水反应 |
SO2+H2O H2SO3 |
H2O+SO3 H2SO4 |
溶于水,不与水反应 |
溶于水 |
|
与金属反应 |
2Na+H2S Na2S+H2↑ |
不反应 |
不反应 |
与较活泼金属反应 |
反应 |
|
|
稳定性 |
不稳定H2S H2+S H2+S |
稳定 |
较稳定 |
不稳定 |
稳定 |
|
|
酸性强弱 |
弱酸性 |
弱酸性 |
强酸性 |
弱酸性 |
强酸性 |
|
|
检验 |
使含Pb2+的湿润试纸变黑或与Cu2+反应生成CuS沉淀 |
使品红溶液褪色加热又重新出现红色 |
与BaCl2 稀现象:生成不溶于稀HNO3的白色沉淀 |
同SO2 |
同SO2 |
1.氧族元素原子结构、单质性质
|
元素名称和符号 |
氧(O) |
硫(S) |
硒(Se) |
碲(Te) |
|||||||
|
原子 结构 |
原子序数 |
8 |
16 |
34 |
52 |
||||||
|
结构示意图 |
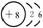 |
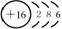 |
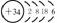 |
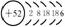 |
|||||||
|
电子式 |
·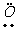 ∶ ∶ |
·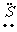 ∶ ∶ |
·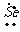 ∶ ∶ |
·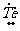 ∶ ∶ |
|||||||
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
-2,+4,+6 |
|||||||
|
相同点 |
最外层电子数相同,都是6个电子 |
||||||||||
|
不同点 |
原子核外电子层数不同,依次增大 |
||||||||||
|
原子半径 |
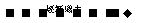 |
||||||||||
|
物 理性 质 |
颜色和状态 |
无色无味气体 |
淡黄固体 |
灰色固体 |
银白色固体 |
||||||
|
密度 |
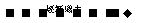 |
||||||||||
|
熔点(℃) |
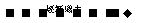 |
||||||||||
|
沸点(℃) |
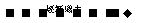 |
||||||||||
|
水、有机溶济溶解度 |
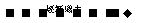 |
||||||||||
|
化学反 |
与金属反应 |
易与金属反应 |
易与金属反应 |
反应较难 |
多数不反应 |
||||||
|
与非金属反应 |
易与H2、C、P、S等反应 |
能与H2、C、O2反应 |
反应难 |
一般不反应 |
|||||||
|
与化合物应 |
能与许多物质反应 |
能与氧化性酸、强碱反应 |
反应少 |
反应很少 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
5.掌握离子反应、离子反应发生的条件及离子方程式的书写。
4.了解硫酸的性质、用途及硫酸根离子的检验;了解几种常见的硫酸盐。
3.掌握工业上接触法制硫酸的反应原理及有关的多步反应的计算;
2.了解硫的氧化物对环境的污染及环境保护的意义;
1.以硫元素为代表,了解氧族元素的单质、氢化物及其氧化物的重要性质;理解氧族元素的性质递变规律;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com