
4.下列过程中,最终的白色沉淀物不一定是BaSO4的是( )
A.Fe(NO3)2溶液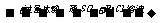 白色沉淀
白色沉淀
B.Ba(NO3)2溶液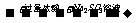 白色沉淀
白色沉淀
C.无色溶液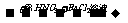 白色沉淀
白色沉淀
D.无色溶液 无色溶液
无色溶液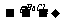 白色沉淀
白色沉淀
考查目的:通过对SO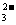 的还原性的考查,训练学生的辨别比较能力。
的还原性的考查,训练学生的辨别比较能力。
3.将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,如将生成的混和气体通过氯化钡溶液,应发生的现象有( )
Fe2O3+SO2↑+SO3↑,如将生成的混和气体通过氯化钡溶液,应发生的现象有( )
A.一定产生BaSO4沉淀 B.一定产生BaSO3沉淀
C.一定有SO2逸出 D.一定有SO3气体逸出
考查目的:通过对SO2、SO3水溶液性质的考查,要求学生有准确的分析及推断能力。
2.下列氢化物的还原性按由强到弱的顺序排列的是( )
A.H2Se>H2S>HI>HBr>HCl B.H2S>H2Se>HI>HBr>HCl
C.HI>HBr>HCl>H2S>H2Se D.H2Se>H2S>HCl>HBr>HI
考查目的:考查一些非金属元素氢化物的还原性大小的比较。
1.下列说法不正确的是( )
A.硫是一种淡黄色的能溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与氧属于同一主族
D.硫在空气中的燃烧产物是SO2,在纯氧中燃烧产物是SO3
考查目的:考查硫单质以及硫化物的一些物理和化学性质。
6.H2S燃烧的两个反应:不完全燃烧
2H2S+O2 2S+2H2O…………a
2S+2H2O…………a
2H2S+3O2 2SO2+2H2O………b
2SO2+2H2O………b
①当H2S为定值时,a式表示O2不足,b式表示O2充足;
②当O2为定值时,b式表示H2S不足,a式表示H2S充足;
③当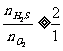 ,按a 式反应,产物全是S;
,按a 式反应,产物全是S;
当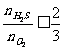 ,按b式反应,产 物全是SO2;
,按b式反应,产 物全是SO2;
当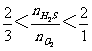 ,按a式和b式反应,产物是S和SO2;
,按a式和b式反应,产物是S和SO2;
5.硫酸的化学性质①不挥发性强酸,如制取HF、HCl、HNO3等②浓硫酸特性(ⅰ)脱水性指将有机物中的H、O元素按水的组成(2∶1)比脱去(ⅱ)吸水性;但不能用浓硫酸干燥NH3、H 2S、HBr、HI等。(ⅲ)强氧化性,但常温下不与Fe、Al等金属反应。
4.离子反应是指在溶液中(或熔化状态)有离子参加或生成的反应离子反应发生的条件是反 应前后至少有二种离子的数目发生了改变。离子方程式表示了反应的实质即所有同一类型的 离子之间的反应。其书写原则是:可溶性或微溶性的强电解质写离子形式,多元弱酸的酸式盐写成酸式根形式,其它物质写分子式或化学式。检查离子方程式是否正确的三个规则①质量守恒--微粒种类与数目相等,②电荷守恒--方程式两边电荷总数相等,③得失电子相等--属于氧化还原反应的离子反应中得失电子数相等。离子共存问题应转化为离子之间能否反应来考虑。
2.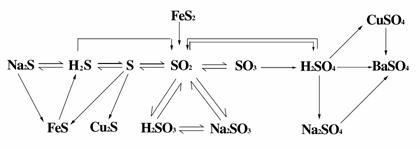 硫的四种价态间的含硫物质之间的网络关系
硫的四种价态间的含硫物质之间的网络关系
①H2S是具有臭蛋气味的剧毒气体,其水溶液--氢硫酸是一种具有挥发性的二元弱酸,硫化氢、氢硫酸都具有强还原性可被碘水、溴水、氯水、FeCl3溶液、HNO3等氧化。H2S能燃烧,燃烧依反应条件不同而不同。
②硫与Fe、Cu反应时,由于其非金属性比氯弱,所以生成低价态的物质FeS、Cu2S。
③硫的氧化物有SO2和SO3,其中SO2是一种有刺激气味的气体,易液化,易溶于水--其水溶液叫亚硫酸、二元弱酸。SO2是重要的大气污染物(其危害详见课本),防治方法有排烟除硫燃料脱硫等。
1.硫单质与氢化物、氧化物的性质及化合价关系
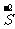

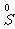

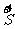

强还原性 氧化性、还原性 强氧化性
特别注意:中间价态的两类硫既有氧化性,又有还原性,SO2、H2SO3、Na2SO3以 还原性为主。
6.常见气体的制取、收集和净化等知识归纳如下:
(1)气体制取装置分为三类,见下图所示。
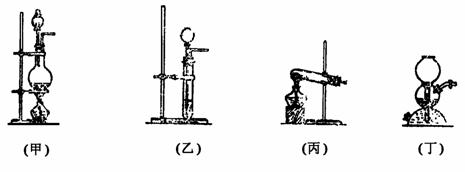 ①固+固
①固+固 ,可选用图(丙)。可制取O2、NH3、CH4等。
,可选用图(丙)。可制取O2、NH3、CH4等。
②固+液 ,可选用图(乙)或(丁)。图(乙)可制取H2、CO2、H2S、NO2、C2H 2等。图(丁)只可制取H2、CO2、H2S(要注意启普发生器使用的三个条件)。
,可选用图(乙)或(丁)。图(乙)可制取H2、CO2、H2S、NO2、C2H 2等。图(丁)只可制取H2、CO2、H2S(要注意启普发生器使用的三个条件)。
③固(或液)+液 ,可选用图(甲)。可制取Cl2、HCl、SO2、CO、NO、C2H2等气体。
,可选用图(甲)。可制取Cl2、HCl、SO2、CO、NO、C2H2等气体。
 (2)气体收集的三种方法:
(2)气体收集的三种方法:
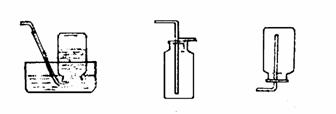
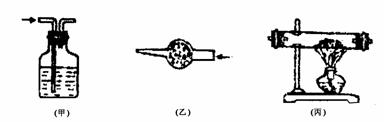 (3)气体净化装置常见的有三种,如下图所示。
(3)气体净化装置常见的有三种,如下图所示。
①装置(甲)是洗气瓶。选择的除杂试剂的是液态。如H2中的HCl用NaOH溶液除去;CO2中的SO2用饱和NaHCO3溶液除去;Cl2中的HCl用饱和食盐水除去;SO2中的SO3用饱 和NaHSO3或H2SO4除去。
②装置(乙)是干燥管。选择的除杂试剂是固态的。如H2中水蒸气可用无水CaCl2;CO中的CO2可用碱石灰。注意气体流入方向:“大进小出”。
③装置(丙)是硬质玻璃管。选择的试剂是固体,需加热时采用此装置。如CO2中的CO用灼热CuO除去,空气中的O2用灼热的铜粉除去。
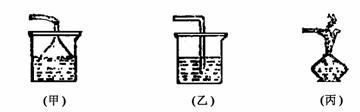 ④尾气吸收装置有三种,如下图所示。
④尾气吸收装置有三种,如下图所示。
①(甲)是易溶于水的气体的吸收装置。如用水吸收HCl、NH3,用NaOH溶液吸收HCl,用氨水吸收SO2等。
②(乙)是能溶于溶液的气体吸收装置或有毒气体的尾气处理装置。如用NaOH溶液吸收Cl2、H2S,用CuSO4溶液吸收H2S等。
③(丙)是CO在空气中点燃的方法处理,防止污染大气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com