
教学时数:两课时
教学内容与步骤:
第一课时
教学要点:
1、指导学生熟读课文,背诵第一、三段,整体感知课文大意;
教学重点、难点
1 (2007全国卷1 )6 下列有关环境问题的说法正确的是
A.燃煤时加入适量石灰石.可诚少废气中SO2 的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在 5.6-7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解.故不会导致水体污染
2(2007全国卷山东考题)9.下列叙述正确的是
A.目前加碘食盐中主要添加的KIO3
B.日常生活中无水乙醇常用于杀菌消毒
C.绿色食品是不含任何化学物质的食品
D.在空气质量日报中CO2含量属于空气污染指数
3(2007全国高考上海卷)11有关物质燃烧时火焰颜色描述错误的是
A 氢气在氯气中燃烧-苍白色 B 钠在空气中燃烧--黄色
C 乙醇在空气中燃烧--淡蓝色 D 硫在氧气中燃烧--绿色
4(2007全国卷宁夏考题)12. a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
5(2007全国卷重庆考题)26.(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 .
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 .
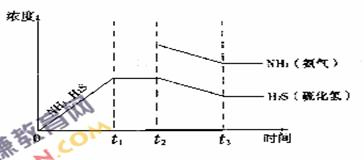
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气.
①当反应达平衡时ρ氨气×p硫化氢=a(Pa2),则容器中的总压为 Pa;
②题26图是上述反应过程中生成物浓度随时间变化的示意图.若t2时增大氨气的浓度且在t3时反应再次达到平衡,诸在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.

26.(14分)
(1)2Fe2++H2S=S↓+2Fe2++2H
(2)Na2S+2H2O S↓+H2↑+2NaOH或S2++2H2O
S↓+H2↑+2NaOH或S2++2H2O S↓+ H2↑+2OH-
S↓+ H2↑+2OH-
副产氢气,生成的NaOH可循环利用.
(3) ①2/3
②
6(2007全国卷宁夏考题)31.化学选考题(15分)
A.[化学-选修化学与技术]
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%);
(1) 已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
A.[化学-选修化学与技术]
(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;
(2)增大压强对提高SO2转化率无显著影响,反而会增加成本;
(3)否 否
(4)浓硫酸
(5)解:1万吨98%的硫酸含H2SO4的质量:9.8×109g
设需要SO3的质量为x,该反应产生的热量为y。
21.某工厂处理含二氧化硫废气时采用“将二氧化硫转化为硫酸铵”的方法。该厂初步处理
后的废气中氧气的体积分数为10%,二氧化硫的体积分数为0.2%。使该废气在400℃时以5m3/h的速率通过催化剂层与速率为20L/h的氨气混合,再喷水使之发生反应,2NH3+H2SO4 (NH4)2SO4将得到的溶液在结晶装置中处理,可得到硫酸铵晶体。将气体都折合为标准状况下进行计算:
(NH4)2SO4将得到的溶液在结晶装置中处理,可得到硫酸铵晶体。将气体都折合为标准状况下进行计算:
(1)该工厂为什么将废气以5m3/h的速率与速率为20L/h的氨气混合为最佳配比(用计算说明 )?
(2)若该厂每天排放10000m3这种废气,按上述方法该厂每月(30天)计算可得到硫酸铵多少 吨?消耗氨气多少m3?
考查目的:本题是为保护环境处理废气中的SO2的方法之一,并且要从量的角度对处理过程中所涉及的反应物、生成物进行计算。培养学生的环保意识及分析处理实际问题的能力。
20.将amol H2S和1mol O2置于一个容积可变的容器内进行反应。维持容器内气体的压强不变(101KPa),在120℃下测得反应前后容器内气体的密度分别为d1和d2。若a的取值不同,则H2S的氧化产物可能有如下三种情况:
(1)全部是SO2,此时a的取值范围是 。
(2)全部是S,此时a的取值范围是 ,并且d1 d2(填“小于”、“大于”或“等于”)。
(3)部分是SO2,部分是S,此时a的取值范围是 。反应所生成SO2的物质的量为 mol。容器内气体的物质的量之和为 mol(以含a的代数式表示)。
考查目的:H2S气体的燃烧问题是一个考试热点,完成本题要对H2S燃烧原理、条件非常熟练。考查学生的综合解题能力。
19.有一瓶亚硫酸钠溶液已部分氧化变质:2Na2SO3+O2 2Na2SO4,某学生
设计了下列实验,确定Na2SO3的纯度:
2Na2SO4,某学生
设计了下列实验,确定Na2SO3的纯度:
①称取ag样品。称量时所用主要仪器的名称是
②样品的溶解。溶解过程中使用玻璃棒搅拌的目的
③在溶液中加入过量的BaCl2溶液且用盐酸酸化。
(1)为什么要用盐酸酸化?
(2)BaCl2为什么要过量?
(3)怎样检验BaCl2溶液是否过量?
(4)为什么要洗涤沉淀?
(5)怎样洗涤沉淀?
(6)怎样判断沉淀是否洗净?
(7)烘干沉淀并计算。烘干后称量沉淀质量为bg,列出计算Na2SO3纯度的计算式。
考查目的:这是一道综合实验题,要回答完整本题必须对这个实验有一条清晰的实验方案, 考查实验能力。
18.某无色溶液可能含有下列钠盐中的几种:(A)氯化钠 (B)硫化钠 (C)亚硫酸钠 (D)硫 代硫酸钠 (E)硫酸钠 (F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同 时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根 据上述实验现象回答下列问题。
(1)不能使品红试液褪色,说明该气体中不含 (填分子式) 。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母)。
第一种情况是 ,第二种情况是 ,第三种情况是
,第四种情况是 。(可不填满,也可补充)
考查目的:有关硫的化合物的知识和思维能力。
17.将0.8g某种铁的硫化物在O2流里灼烧,使硫全部氧化为二氧化硫,再将所得的SO2通过氧化剂使之全部转化为三氧化硫,并与水化合完全转化为硫酸。这些硫酸恰好与40ml0.5 mol/L NaOH溶液中和,则某种铁的硫化物中含硫的质量分数 。
考查目的:这是一道多步反应的计算题,只要从多步反应中找出需要的关系式,便能解答。 训练学生的归纳、分析能力。
16.氯酸钾和亚硫酸氢钠间氧化还原反应生成Cl-和S+6的速度,如下图所示,又已知这个反应的速度随着溶液中氢离子浓度增大而加快。
(1)为什么反应开始时反应速度加快?
(2)为什么后期反应速度下降?
考查目的:本题涉及的知识是氧化还原反应,仔细分析反应式,是能回答问题的,考查分析问题能力。
15.摄影工艺中的废定影液的PH值小于7,其中含有银的复杂化合物,为了回收银,进行如下操作:向盛有定影液的烧杯中,加入少量稀NaOH溶液,再加入硫化钠溶液,生成黑色沉淀。过滤,将固体移入坩埚中加碳酸钠和硼砂(催化剂)混合加热,放出二氧化碳和氧气。将残留的固体用水洗涤,即得到固体银,而洗涤液中主要含有硫化钠,试回答下列问题:(1)开始时为何要向废液中加入少量氢氧化钠溶液?(2)过程中的黑色沉淀物质是什么?(3)写出加热时坩埚内发生的反应的化学方程式。
考查目的:这是一道信息题,用学习过的化学知识解释实际问题,培养学生解决实际问题的 能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com