
(三)碳酸、碳酸盐及酸式碳酸盐
(1)碳酸(H2CO3),不稳定,一般在方程式中写作CO2和H2O,二元弱酸。
(2)热稳定性:正盐>酸式盐>酸,例如:Ca(HCO3)2 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O,而Na2CO3强热也难分解。Ca(HCO3)2在溶液中可以分解,而NaHCO3在溶液中稳定,加热固体可以分解。
Na2CO3+CO2↑+H2O,而Na2CO3强热也难分解。Ca(HCO3)2在溶液中可以分解,而NaHCO3在溶液中稳定,加热固体可以分解。
(3)溶解性:第ⅡA族碳酸的正盐小于酸式盐,而第ⅠA族的正盐大于酸式盐。
例如:S(CaCO3)<S[Ca(HCO3)2]; S(Na2CO3)>S(NaHCO3)
(4)正盐与酸式盐可以相互转化:
CO
 HCO
HCO
思考与交流:如何鉴别CO 与HCO
与HCO 离子?
离子?
例4:用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊。再升温至65 ℃以上,溶液变澄清 |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失 |
Na2SiO3溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |
[教学反思]
(二)碳的单质及其氧化物
1、碳的同素异形体包括 (原子晶体) (混合型晶体) (分子晶体)以及无定形碳等,同时分析其构型。
2、碳的化学性质
a.可燃性 b.还原性
例2、在元素周期表中,下列有关碳族元素的递变规律正确的是
A.自上而下元素的金属性逐渐增强 B.自上而下元素的非金属性逐渐增强
C.自上而下元素单质颜色逐渐变浅 D.自上而下元素单质熔、沸点逐渐升高
3、CO与CO2的性质:
C与CO以还原性为主,CO2有氧化性与酸性氧化物通性。
|
|
CO2 |
CO |
|
电子式 |
|
\ |
|
制法 |
工业:
实验室: |
\ |
|
氧化物类型 |
|
|
|
化学性质 |
|
|
例3、CO2通入下列各溶液中,不可能产生沉淀的是
A.CaCl2 B.澄清石灰水 C.饱和Na2CO3溶液 D.Na2SiO3溶液
2、(08年江苏化学·13)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: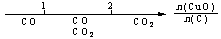
B.Fe在Cl2中的燃烧产物:
C.AlCl3溶液中滴加NaOH后铝的存在形式:
D.氨水与SO2反应后溶液中的铵盐:
感悟高考:
1、(09年海南化学·7)用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
 A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
2、了解常见非金属C、Si及其化合物的主要性质和重要应用。
1、了解非金属原子核外电子排布的周期性与元素性质递变关系,掌握典型非金属碳元素在元素周期表中的位置及性质的关系;
6、完成课后练习
5、讨论:结合上节课反复诵读课文的体会,你认为“情”在本文中有哪几层含意?
4、熟读第四段。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com