
1. 方法指导:
电极反应及电极产物的判断规律:电解质溶液在通直流电时,对电解产物的判断,既要 考虑阴阳离子的氧化还原能力,还要考虑电极材料、离子浓度、溶液酸碱性等。判断电解产物首先要注意电极材料,再根据电解质溶液的离子放电顺序进行判断。
(1)惰性电极电解(Pt、Au、碳棒)
阳离子放电顺序:Ag+>Hg2+>Cu2+>H+>Pb2+>Fe2+>┈
阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根例子
下面分四种情况进行说明:
①电解质中溶质的阳离子放电,阴离子不放电:即阳离子的氧化性强于H+,而阴离子的还原性弱于OH--,产物为酸、O2及金属单质,电解后溶液pH减小。如:
a.电解AgNO3溶液产物为Ag和O2、HNO3: 4 AgNO3+2H2O 4Ag+ O2↑+4HNO3
4Ag+ O2↑+4HNO3
b.电解CuSO4溶液产物为Cu和O2、H2SO4: 2CuSO4+2H2O 2Cu+O2↑+ 2H2SO4:
2Cu+O2↑+ 2H2SO4:
②电解质中溶质的阴离子放电,阳离子不放电:即阳离子的氧化性弱于H+,而阴离子的还原性强于OH--,产物为碱、H2及非金属单质。电解NaCl、K2S、KBr、NaI等水溶液都产生氢气,电解后溶液pH增大。如:
2KI+2H2O 2KOH+I2+H2↑
2KOH+I2+H2↑
③电解过程中阴阳离子都放电:即阳离子的氧化性强于H+,而阴离子的还原性强于OH--。如:电解CuCl2水溶液或H+与S2-、I-、Br-、Cl-组成的酸。
CuCl2 Cu+Cl2↑
Cu+Cl2↑
2HCl H2↑+Cl2↑
H2↑+Cl2↑
④电解过程中阴阳离子都不放电:即阳离子的氧化性弱于H+,而阴离子的还原性弱于OH-。
如电解Na2SO4、NaOH、HNO3、H2SO4等水溶液。电解质仅起到增强导电性的作用。pH的变化应分两种情况考虑:若原溶液是饱和溶液,则溶液浓度不再改变,pH也不再改变;若原溶液是不饱和溶液,则随着水的电解,溶液浓度增大,又有三种情形:
①若原溶液是酸性的,则酸性会更强,pH减小,如H2SO4等。
②若原溶液是碱性的,则碱性会更强,pH增大,如NaOH等。
③若原溶液是中性的,则pH不变,如K2SO4等。
(2)金属电极做阳极时:
金属阳极比电解质溶液中的阴离子容易放电,所以易于失去电子被氧化而溶解,形成金属阳离子进入溶液中,此时溶液中的阴离子不放电。具体应用有:电镀和金属的精炼。比如:用铜棒做电极电解NaCl溶液时,电极反应为:
阳极:Cu –2e-- == Cu2+
阴极:2H+ +2e-- == H2↑
2.例题解析
[例1]下图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板有无色无臭气体放出,符合这一情况的是( )
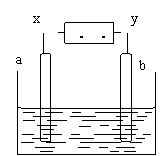
|
|
a极板 |
b极板 |
x电极 |
y电极 |
|
A |
锌 |
石墨 |
负极 |
CuSO4 |
|
B |
石墨 |
石墨 |
负极 |
NaOH |
|
C |
银 |
铁 |
正极 |
AgNO3 |
|
D |
铜 |
石墨 |
负极 |
CuCl2 |
解析 根据题意,a极板质量增加,说明电解时有金属析出,发生还原反应,a极应是阴极,x电极应是负极,所以选项c不符合题意;选项B为NaOH溶液,电解时不可能有金属在阴极析出,故选项B也不符合题意。题中已知b极板有无色无臭气体放出,则此气体为氧气,故选项D不符合题意。因此答案为A.。
[例2]pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
解析 电解NaOH溶液相当于电解水,NaOH溶液浓度增大,使溶液的pH升高,A符合要求;电解H2SO4和电解Na2SO4溶液相似,都使溶液浓度增大,所以溶液的pH分别减小、不变,两者均不符合要求;电解AgNO3溶液生成HNO3,溶液的pH减小。所以答案为A。
[例3]下列有关用惰性电极电解AgNO3溶液一段时间后的说法正确的是( )
A.电解过程中阴极质量不断增加
B. 电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况
D.电解后两极产生的气体体积比为2∶1
解析 处理有关电解问题首先注意电极材料,在此基础上写出电机反应和总的电解方程式,根据总的电解反应式来分析电解前后的物质变化和溶液浓度变化,分析溶液的pH变化必须注意原溶液的pH情况。
用惰性电极电解AgNO3溶液,总的电解方程式为:
4 AgNO3+2H2O 4Ag+ O2↑+4HNO3
4Ag+ O2↑+4HNO3
可知:阴极上析出银,阳极上放出氧气,故A正确D错误;由于生成HNO3,溶液的Ph应不断降低,B错误;要使溶液恢复电解前的状况要看加入的物质在溶液中的反应:
2Ag2O+4HNO3 == 4 AgNO3+2H2O,得到的物质恰好是反应掉的物质,可使溶液恢复电解前的状况。C正确。
故正确答案为A、C
 [例4]下图装置中,通电后可观察到Cu极溶解。下列说法中正确的是( )
[例4]下图装置中,通电后可观察到Cu极溶解。下列说法中正确的是( )
A.a极是直流电源的正极
B.Fe极是阳极
C.Pt极产生的气体体积是Ag极产生气体体积的2倍
D.硫酸铜溶液的浓度不变
解析 这是两电解池串连的情况,其特点是:所有电极上通过的电量相等,其电极及电极反应互不影响,与单个电解池相同。Cu极溶解,则其必为阳极(电解池中阳极质量不可能增加,阴极质量不可能减小),Fe极是阴极;b极是直流电源的负极,a极是直流电源的正极;Pt极为阳极,Ag极为是阴极。电解H2SO4溶液Pt极产生O2,Ag极产生H2,O2应为H2的1/2。电解CuSO4溶液,Cu为阳极,Fe极是阴极,是向Fe极上镀铜的过程,硫酸铜溶液的浓度不变。
基础训练
2. 电镀后阳极质量_______,阴极质量__________,电解液浓度_____________。
学习导航
1. 以铁上镀铜为例,说明电镀所满足的基本条件
①___________________________________;
②___________________________________;
③___________________________________。
画出电解精炼铜的装置图,并写出两电极的反应。
(1)组成电解池的条件是:
①__________________________________________;
②__________________________________________;
③__________________________________________。
(2)右图是电解饱和食盐水的装置图,请思考以下问题:

|
|
现象 |
电极反应式 |
|
阴极 |
|
|
|
阳极 |
|
|
|
总反应的化学方程式: |
7.电解: ___________________________________________________的过程叫做电解。
6. 与电源正极相连的电极我们称之为________,在这一极上发生的
电极反应式为_______________;而与电源负极相连的电极我们称之
为__________,在这一极上发生的电极反应为_______________。由
实验可知熔融的氯化钠通电时,在两极上均发生了氧化还原反应,有
新物质生成,此过程中___能转化为____能。
5. 通电后,_____极上逐渐覆盖了一层银白色的物质,这是因为析
出了______。______极上有气泡产生,并可闻到_______的气味,该
气体是________。可见通电后,两电极上都发生了化学变化。
4. 通电前这些离子做___________________运动。
3. 通电前,熔融的氯化钠中存在_______________________离子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com