
2.叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击时会发生爆炸生成氮气。有关叠氮酸的叙述中正确的是
①NaN3 的水溶液呈碱性 ② HN3 的固体属于共价化合物
③NaN3 的固体属于离子化合物 ④NaN3可用于小汽车防撞保护气囊
A、①②③ B、②③④ C、①③④ D、①②③④
1、生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是
A、Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂。
B、用灼烧并闻气味的方法区别纯棉织物和纯毛织物。
C、某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2。
D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
39.某化学反应2A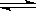 B+D在四种不同条件下进行,B、D起始浓度为0,见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
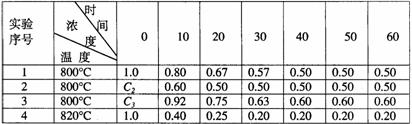
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
理由是 。
(3)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(4)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<=),且C3 1.0mol/L(填>、=、<=)
38.现用硫铁矿制取硫酸,再用硫酸制取化肥硫酸铵。今燃烧含FeS2 80%的硫铁矿75.0 t。若FeS2转化为H2SO4的转化率为70%,在制取硫酸铵时硫酸的利用率为90%,试求生产出多少硫酸铵。
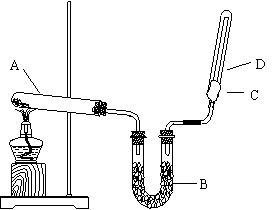
37.如上图所示,实验室用NH4Cl和Ca(OH)2制取NH3 。试回答下列问题:
(1)画出NH3的电子式________
和结构式 。
(2)B处的药品是 。
(3) 用向下排空气法收集NH3时,C处
棉花上应蘸取 。
(4)检验D处试管中NH3是否收集满,除用湿润的红色石蕊试纸外,还可采用什么简易方法。
_________
(5)在标准状况下,收集满一试管NH3后,将该试管放入水中,则最后所得溶液的物
质的量浓度为 mol/L 。
36.H2O由液态变为气态的过程可以用下式来表示:H2O(l)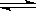 H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
(1)减小压强,平衡向 移动。所以高山上由于空气稀薄,水的沸点比平地上 (填高或低)。
(2)如果在常压下往水中加入少量的NaCl固体,则水的沸点 (填升高,降低或不变)。
35.将除去氧化膜的镁条插入到稀盐酸溶液中, 发现生成氢气的速度变化情况如下图所示:
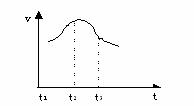 其中t1-t2 速度变化的主要原因是
其中t1-t2 速度变化的主要原因是
____________________________________
t2-t3 速度变化的主要原因是
_____________________________________________________
34.在体积一定的密闭容器中放入3LR和5LQ气体,发生如下反应:
3R (g) + 5Q (g) === 4X (g) + nY (g),反应完后,保持容器温度不变,测得混合气体的压强是原来的87.5%,则化学方程式中n的值为 。
33.(1) 完成并配平化学方程式(在空格内填入系数或化合物的分子式)
□KMnO4+□KNO2+□ ====== == □MnSO4+□K2SO4+□KNO3+□H2O
(2) 工业废气和汽车尾气排出的氮的氧化物,是空气的重要污染源。目前治理NO污染的方法之一是在400℃左右,有催化剂存在的条件下用NH3将NO还原为 N2和H2O。写出配平后的化学反应方程式: 。
(3) 科学家发现NO除了① 形成酸雨 ② 破坏臭氧层 ③ 与人体血红蛋白化合④ 形
成光化学烟雾外,少量的NO 还是有益的。NO 曾被美国杂志评为“明星分子”,近年来
发现少量的NO 在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,
而成为生命科学研究的热点。
在含 Cu + 的酶的活化中心,亚硝酸根离子可转化为NO。写出 Cu + 和亚硝酸根离子在酸性溶液中的反应的离子方程式(Cu + 被氧化为Cu 2+)。
。
31一定的条件下, 可逆反应: A2(气) + 3B2(气)  2C(气) 达到了化学平衡状态, 测得平衡时 [A2] = 0.5 mol/L, [B2]
= 0.1 mol/L, [C] = 1.6 mol/L. 若A2、B2、C 的起始浓度分别为 a mol/L, b mol/L, c mol/L, 试回答:
2C(气) 达到了化学平衡状态, 测得平衡时 [A2] = 0.5 mol/L, [B2]
= 0.1 mol/L, [C] = 1.6 mol/L. 若A2、B2、C 的起始浓度分别为 a mol/L, b mol/L, c mol/L, 试回答:
(1) a 和 b 应该满足的关系是 _______________________
(2) a 的取值范围是 ____________.
32. As2S3与稀HNO3反应产生砷酸,反应式为:
3 As2S3 + 28 HNO3 + 4 H2O ======= 6 H3AsO4 + 9 H2SO4 +28NO ,
在此反应中, HNO3表现了 性。若有0.3mol As2S3参加反应,共有_______ mol电子发生转移。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com