
10.(舟山中学2008学年第二次月考)将PH=1的稀硫酸慢慢加入一定量的BaCl2溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100mL(混合时溶液体积变化忽略不计),PH为2,则原BaCl2溶液Cl-的浓度为
A.0.011 mol·L-1 B.0.22 mol·L-1 C.0.022 mol·L-1 D.0.11 mol·L-1
11(浙江省开化中学08年1月高三模拟).设NA为阿伏加德罗常数,则下列说法正确的是
A.22.4 L乙烯中含有的分子数为NA
B.0.1 L 0.1 mol/L的CH3COOH溶液中含有的分子数为0.01 Na
C.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数0.1Na
D.1 mol SiO2晶体中含有2Na个Si-O键
9.(舟山中学2008学年第二次月考)某化学兴趣小组用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是
A.常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0.45 -0.6 mol之间
D.常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0.45 -0.6 mol之间
8.(舟山中学2008学年第二次月考)NA表示阿伏加德罗常数,下列说法正确的是
A.铁、铜和稀硫酸构成原电池,当转移NA个电子时,产生的气体体积为11.2L
B.7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA
C.1molC30H60分子中含共价键总数为90NA
D.18g重水中含有的电子数为10NA
7.(08学年度杭州学军中学高三年级第二次月考)下列叙述正确的是 ( B )
A.相同条件下,N2和O2的混合气体与等体积的N2所含原子数相等
B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16g CH4与19g NH4+所含质子数相等
6.(浙江九所重点中学高三年级调研考试)t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是
A.t℃时原溶液是不饱和溶液 B.若A是CuSO4,则7.5 g晶体中含水2.7 g
C.t℃时A的溶解度为75 g D.原溶液中A的质量分数为40%
5.(浙江九所重点中学高三年级调研考试)用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
3.(金丽衢十二校高三第一次联考化学模拟)将Cu与Fe2O3的混合粉末a g与1mol/L硫酸进行反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中无Fe3+,则
a= ,混合粉末中铜的质量为 。
(2)若将固体完全溶解于1.00L上述硫酸中,测得c(Fe3+)=0.1mol/L(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为 g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中既有Fe3+,也有Fe2+,则 a 的取值范围是 。
答案:(10分)(1) 22.4(2分) 6.4g (2分)(2)18.1(3分) 16<a<22.4 (3分)
4(杭州市2008年高三第一次高考科目教学质量检测化学).阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是
A.1.0L 1mol/L氨水中,NH3·H2O的分子数为6.02×1023
B.2.4g金属镁变为镁离子时失去的电子数为0.2×6.02×1023
C.白磷分子(P4)呈正四面体结构,31g 白磷中含有P-P键个数为6×6.02×1023
D. 20g 重水(2H216O)中含有的中子数为8×6.02×1023
2、(温州市十校联合体高三联考)某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为
A.11.2g B.16.8g C.19.6g D.22.4g
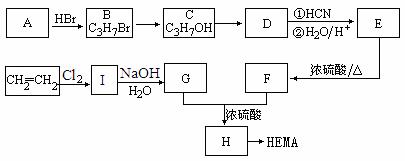
19.软性隐形眼镜可由聚
甲基丙烯酸羟乙酯(HEMA)
制成超薄镜片,其合成路
线可以是:
已知⑴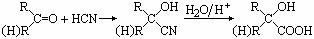
⑵CH3COOCH2CH2OH的名称为乙酸羟乙酯
试写出:
(1)A、E的结构简式分别为:A 、E 。
(2)写出下列反应的反应类型:C→D ,E→F 。
(3)写出下列转化的化学方程式:
I→G ;
G+F→H 。
18.在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加一对共用电子对。
试回答:(1)分子式为CnH2n+2的烃分子中碳碳间共有电子对数为 _。
(2)分子式为CnH2n-6的烃分子中碳碳间共用电子对数为 ___ __。
 (3)Cx可看做是烃减氢后的产物,若某物质分子中碳碳间的共用电子对数为160,则符合该条件的碳单质的分子式为 ;符合该条件的单烯烃的分子式为 。
(3)Cx可看做是烃减氢后的产物,若某物质分子中碳碳间的共用电子对数为160,则符合该条件的碳单质的分子式为 ;符合该条件的单烯烃的分子式为 。
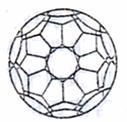
 (4)目前,化学家们已经找到十余种富勒烯家族的Cx,它们分子结构中都有由正五边形和正六边形构成的封闭的凸多面体,C60就是其中的一种富勒烯,其结构如图所示。第(3)小题中的Cx也是其中一种富勒烯,则第(3)小题Cx结构中五边形和六边形的个数分别是
和
。(提示:欧拉定理:顶点数+面数-棱数=2)
(4)目前,化学家们已经找到十余种富勒烯家族的Cx,它们分子结构中都有由正五边形和正六边形构成的封闭的凸多面体,C60就是其中的一种富勒烯,其结构如图所示。第(3)小题中的Cx也是其中一种富勒烯,则第(3)小题Cx结构中五边形和六边形的个数分别是
和
。(提示:欧拉定理:顶点数+面数-棱数=2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com