
21.(10分)下列所述各微粒都是由短周期元素组成的。
(1)由两种短周期元素组成的A、B两种分子,分子中电子总数均为18个且相对分子质量相同。若A、B能发生氧化还原反应,生成黄色的固体单质。请写出该反应的化学方程式____________ __;
(2)己知肼(H2N-NH2)和甲胺(CH3-NH2)都是18个电子的分子,根据肼和甲胺的结构特点,写出两种具有18个电子的有机化合物的结构简式 ________,
(3)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。W与Z为同周期;W和Y不属同一主族;Y元素原子最外层电子数占核外总电子数的3/4; W元素原子最外层电子比Z元素多5个电子。请写出由Z、W两元素组成的化合物的电子式_________
(4)由X和Y两元素可形成C+、D-、E三种微粒(分子或离子),它们都分别含有10个电子,巳知它们有如下转化关系D-+C+ =2E;请写出与微粒D-组成完全相同但不带电的另一种微粒的电子式
20.(6分)A、B、C、D、E的原子序数均≤20,且原子序数依次增大,其中A、D同主族,B、C、D同周期,B、C、D最高价氧化物对应的水化物均能相互反应生成盐和水。A、B、E的单质均能和水剧烈反应,E2+与D的阴离子具有相同的电子层结构。
(1)A、C、D、E四种元素的原子半径由小到大的顺序是__________(用元素符号表示)。
(2)A和D的氢化物中__________(用化学式表示)的沸点较高,原因是___________。
(3)写出单质B与水反应的离子方程式_______________________________________。
19.(11分) 2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3 反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是 。
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比为 。
(5)完成下列方程式:
3 Fe + 1NO2- + OH- = 3FeO22- +1H2O + 。
18.(8分)1919年由Langmuir提出了等电子体。原子数相同、电子数相同的粒子,互称为等电子体。A、B、C、D、E 、F 是原子序数(≤20)依次增大的6种位于元素周期表前20号的元素。B、C、D、E位于同周期。C是构成空气的主要元素。F与B、D都可形成XY2型离子化合物FB2、FD2,且都可与A2D(无色液体)反应放出气体。B22-与C2是等电子体,D22-与E2是等电子体。F原子的N层电子数与K层电子数相同。
(1)比较C、D、E对应的简单阴离子的半径(用离子符号表示) (由大到小);
(2)写出能证明D和E非金属性强弱的一个化学方程式 。
(3)由上述6种元素中的4种构成的离子化合物是(写出两种) ,其中所含的化学键类型有 。
16.已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A.Q1+ Q2+Q3 B.0.5(Q1+Q2+Q3 )
C.0.5 Q2-1.5 Q1-0.5Q3 D.1.5 Q1-0.5 Q2+0.5Q3
17某有机物混合物4.6g完全燃烧,将燃烧后的混合物通入过量的澄清石灰水,石灰水共增重14.2g,经过滤得到20g沉淀。该有机样品可能是
A. C2H6O2 B. CH4和C2H6的混合物
C. CH4O和C3H8O的混合物 D. C2H6O和C3H8O3的混合物
第Ⅱ卷 非选择题(共49分)
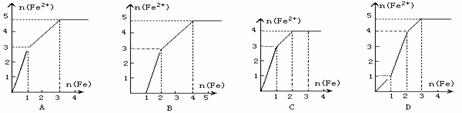
15.某稀溶液中含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉,溶液中Fe2+的物质的量(纵坐标/mol)和加入铁粉的物质的量(横坐标/mol)之间的关系为
14.A、B、C、D、E为原子序数相邻且依次递增的同一短周期元素,下列说法正确的是(m、n均为正整数)
A.若HnEOm为强酸,则D是位于VA族以后的非金属元素
B.若C的最低化合价为-3,则E的气态氢化物的分子式为H2E
C.A、B的最高价氧化物水化物均为碱,则碱性A(OH)n强于 B(OH)n+1
D.若B为金属,则C一定为金属元素
13.X、Y是周期表中的两种元素,X原子的半径比Y的半径小,且具有相同的电子层数,(选项中m、n均为正整数)下列有关叙述正确的是
A.若X、Y原子序数相差1,Y为ⅡA族,则X一定是ⅢA族
B.若HnXOm为强酸,则X的氢化物溶液于水一定显酸性
C.若Y(OH)m易溶于水,则X(OH)n一定不溶于水
D.若Y元素形成的单质是气体,则X元素形成的单质一定也是气体
12.已知S2O8n-离子和H2O2一样含过氧键,因此也有强氧化性, S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子变成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2则S2O8n-中的n值和S元素的化合价是
A.2, +6 B.2, +7 C.4 ,+7 D.4 , +4
11.X、Y都是短周期元素,原子半径Y>X,它们可能形成的化合物为XY2,由此得出的正确判断是
A.X、Y可能在同一周期 B.X在Y的前一周期
C.X一定是金属元素 D.X一定是第三周期ⅡA或ⅣA族元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com