
2. (2003年南京市高三化学模拟题)以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜(CuSO4·5H2O)。制取硫酸铜晶体的过程如下图所示。
(2003年南京市高三化学模拟题)以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜(CuSO4·5H2O)。制取硫酸铜晶体的过程如下图所示。
(1)写出制取硫酸铜的总反应方程式 。
(2)在上述生产过程中,被循环使用的物是 。
 (3)请你选用下列适宜的装置来模拟上述生产过程。将它们的编号填入方框。
(3)请你选用下列适宜的装置来模拟上述生产过程。将它们的编号填入方框。

(本题考查了学生对几种常见物质性质的掌握情况及分析评价能力。答题时由题给条件确定反应原理,看懂流程图,明确各步的实验目的,通过分析、比较确定方案。)
新活题网站
1. (2000年上海高考题)某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
(2000年上海高考题)某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
(1)实验目的: 。
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)。
表1 实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=_________。(用含W、m1、m2的代数式表示。)
|
实验过程 |
实验现象 |
有关化学方程式 |
 在C中加入样品标本W克,D中装入药品后并称量为m1g。连接好仪器后,检查气密性 在C中加入样品标本W克,D中装入药品后并称量为m1g。连接好仪器后,检查气密性 |
 |
|
|
打开A的活塞,慢慢滴加溶液。 |
|
|
|
对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: |
|
|
 冷却后,称量D的质量为m2克。 冷却后,称量D的质量为m2克。 |
 |
|
(5)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的装置可以是_____________,其中盛放的药品是____________。
(该题是对一个相对完整的实验方案加以分析、推理、评价的综合性实验简答题,意在考查学生的观察能力、实验能力和思维能力。解答此题的关键在实验报告的仪器和药品一项,由此可确定反应的装置和反应原理。)
2.化学实验方案设计的一般方法
(1)明确目的原理
首先必须认真审题(如要求采用最简单或最佳的方案,制取纯净的某物质等),明确实验的目的要求。弄清题目有哪些新的信息,综合已学过的知识,通过类比、迁移、分析,从而明确实验原理。
(2)选择仪器药品
根据实验的目的和原理,以及反应物和生成物的性质、反应条件,如反应物和生成物的状态、能否腐蚀仪器和橡皮,反应是否加热及温度是否控制在一定范围,给出的药品、仪器或装置是否足够,需要补充还是筛选,仪器药品的规格等。从而选择合理的化学仪器和药品。
(3)设计装置步骤
根据上述实验目的和原理,以及所选用的实验仪器和药品,设计出合理的实验操作步骤、实验装置。学生应具备识别和绘制典型的实验装置图的能力,实验步骤应完整而又简明。
(4)记录现象数据
根据观察,全面准确地记录实验过程中的现象和数据。
(5)分析得出结论
根据实验观察的现象和记录的数据,通过分析、计算、图表、推理等处理,得出正确的结论。
典型题点击
1.化学实验方案设计的基本要求
化学实验方案的设计基本要求是方法简便、原料或药品易得、现象明显、操作易行、环保防污。
6.(1)①Ⅱ ABC ② 银氨溶液;试管内壁产生银镜
 CH3CHO + 2[Ag(NH3)2]+
+ 2OH- CH3COO- + NH4+
+2Ag↓+ 3NH3
+2H2O
CH3CHO + 2[Ag(NH3)2]+
+ 2OH- CH3COO- + NH4+
+2Ag↓+ 3NH3
+2H2O
③ 水浴加热,温度计控温78℃或略大于78℃
(2)① F、G、E防止空气中H2O和CO2进入E,引起测定误差 ② 防止加热时产生的水蒸气在试管口部分冷凝回流支试管底部,引起炸裂

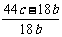 (3)
或
(3)
或
5.(1)D(2)加入的液溴颜色基本不褪(3)除去过量的溴(4)四氢化萘、铁粉(5)1.3
讲析:本题主要考查考生对实验目的、原理是否理解,同时考查考生能否仔细审题和利用题目中提供的信息来解答问题。
按照步骤①,本实验是把四氢化萘、水和铁粉加入同一容器中进行反应,所以B不是正确选项。若用A中的装置进行反应,溴蒸气和刺激性气味的四氢化萘都会污染环境,同样C装置在步骤②反应时,也会造成环境污染,所以A和C都不是正确选项。正确选项是D。根据题中所提供的信息,四溴化萘是不溶水的固体,四氢化萘和氢溴酸溶液都是无色的,反应完全时,四氢化萘已基本消耗完,加入的溴溶于水中使溶液呈棕黄色。在步骤③中补充少量四氢化萘则是为了除去溶液中过量的溴。从题中可知过滤后得到的固体物质只能是四溴化萘和作为催化剂的铁粉。由反应方程式可知,1 molC10Hl2(132 g/mol)与溴反应后产生4molHBr(81 g/mol),又知反应条件下得到的氢溴酸饱和溶液中HBr的质量分数是66%,所以含4molHBr的饱和溶液中水的质量是(81×4)×34%÷66%,所以步骤①中四氢化萘和水的质量比应是: 132:[(81×4)×34%÷66%]=1:1.3
4.(1)N2、O2的体积 (2)偏低
(3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也对)
(5)bceg或beg或ceg
3.(1)能; 不能; 不能。
(2)排尽整个装置中的空气,防止产生的NO被空气中的O2氧化
(3)(D)装置中通入O2后有红棕色气体生成
讲析:一般验证NO气体的方法是:使它与O2接触,发生反应生成红棕色NO2气体,由颜色变化可以判断原来有无NO存在。要验证铜和适量浓硝酸反应产生的气体中含有NO,而该反应产生的气体主要成分是NO2,这就是说要从NO和NO2的混合气体中验证NO的存在。为此要做到:①反应前应将装置内空气赶尽,防止NO被氧化;②将混合气体中NO和NO2分离,可由题给的NO和NO2的液化温度,通过F装置完成;③反应混合气中少量的水蒸气冷凝后溶解NO2,会产生NO,需对混合气进行干燥,这可由C装置完成。
2.
|
实验方法 |
实验过程中所发生
反应的化学方程式 |
实验所用仪器 (用编号表示) |
实验需直接测定的有关物理量 (用文字说明) |
|
1 |
H2SO4+Zn=ZnSO4+H2↑ H2+CuO 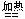 Cu+H2O Cu+H2O |
①②③⑦ |
实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量) 实验后Cu及硬质玻璃管的总质量 |
|
2 |
H2SO4+CuO=CuSO4+H2O |
①⑤⑧⑨ |
过滤后剩余固体的质量 |
|
3 |
2Cu+O2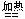 2CuO 2CuO |
①④⑥⑦⑧ |
实验前坩埚与样品总质量 (或坩埚质量) 实验后坩埚与CuO总质量 |
(以上三种方法任选两种,其它合理的方法也可以)
1.选择试剂 ⑦ ⑤ ②
选择操作 A B A
讲析:杂质NH4+和HCO3-用OH-除去,杂质SO42-用Ba2+除去,综合考虑用Ba(OH)2溶液最佳,此时产生了BaCO3、BaSO4沉淀及NH3·H2O,用加热法使NH3·H2O分解而除去,考虑到除杂试剂过量,用Na2CO3溶液使多余的Ba2+成为BaCO3沉淀,将两步产生的沉淀一起过滤,减少了操作步骤。最后用适量稀HNO3除去OH-、CO32-,再加热赶掉溶解在其中的CO2即可。符合题中要求选用试剂不超过3种,操作简单且步骤少,既除杂又配成NaNO3溶液。若开始选用NaOH溶液、Ba(NO3)2溶液,则选用试剂超过3种。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com